题目内容
【题目】下列说法正确的是
A. 在相同条件下PH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,水的电离程度前者比后者大
B. 反应NH3(g)+HCl(g) ![]() NH4Cl(s)能自发进行,则该反应ΔH>0
NH4Cl(s)能自发进行,则该反应ΔH>0
C. 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了c(H+)
D. 一定条件下,反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
【答案】D
【解析】A.CH3COOH因电离抑制水的电离,NH4Cl溶液中因NH4+的水解促进水的电离,则在相同条件下PH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,水的电离程度前者比后者小,故A错误;B.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,△G=△H-T△S<0,△S<0,则该反应的△H<0,故错误;C.锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是置换出的Cu与Zn形成了原电池,加快反应速率,故C错误;D.反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0达到平衡后,升高体系温度,平衡逆向移动,则反应重新达到平衡前v正(O2)<v逆(O2),即有2v正(O2)<v逆(SO3),故D正确;答案为D。
2SO3(g) ΔH<0达到平衡后,升高体系温度,平衡逆向移动,则反应重新达到平衡前v正(O2)<v逆(O2),即有2v正(O2)<v逆(SO3),故D正确;答案为D。

【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
【题目】工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂。但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,夹持仪器省略。
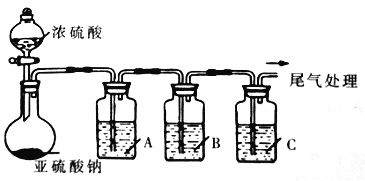
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等。
①请完成下列表格
试剂 | 作用 | |
A | _______ | 验证SO2的还原性 |
B | Na2S溶液 | ___ |
C | 品红溶液 | ___ |
②A中发生反应的离子方程式为_______________________。
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去。该方案是否合理________。(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为____________。
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性。该方案的不妥之处可能为_____________。
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量。取50.00ml葡萄酒样品于250ml碘量瓶中。加入少量碎冰块,再加入1ml淀粉指示液,10ml硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为Vml。以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml。该葡萄酒中SO2含量计算式为___g/L。
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol L-1 min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0
D. 容器乙中若起始时改充0.10 molL-1 NO2和0.20molL-1 SO2,达到平衡时c(NO)与原平衡相同

