题目内容
【题目】工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂。但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,夹持仪器省略。
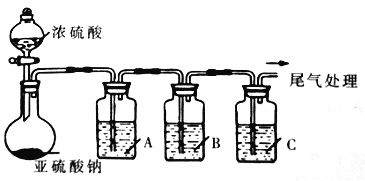
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等。
①请完成下列表格
试剂 | 作用 | |
A | _______ | 验证SO2的还原性 |
B | Na2S溶液 | ___ |
C | 品红溶液 | ___ |
②A中发生反应的离子方程式为_______________________。
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去。该方案是否合理________。(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为____________。
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性。该方案的不妥之处可能为_____________。
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量。取50.00ml葡萄酒样品于250ml碘量瓶中。加入少量碎冰块,再加入1ml淀粉指示液,10ml硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为Vml。以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml。该葡萄酒中SO2含量计算式为___g/L。
【答案】 A.FeCl3溶液 B.验证SO2的氧化性 C.验证SO2的漂白性 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 否 特征的蓝色沉淀 高锰酸钾用硫酸酸化 
【解析】(1)①A装置中要验证SO2的还原性,需要选择氧化剂,而备选试剂中浓硫酸和FeCl3溶液是常见氧化剂,浓硫酸不能氧化SO2,故选择FeCl3溶液;B装置中盛有Na2S溶液,是常见还原性物质,与SO2发生氧化还原反应,可验证SO2的氧化性;SO2具有漂白性,可与 C装置中的品红溶液作用,使品红褪色。综上所述,答案为: A.FeCl3溶液 B.验证SO2的氧化性 C.验证SO2的漂白性 。②Fe3+和 SO2反应,![]() →
→![]() ,
,![]() →
→![]() ,根据得失电子守恒和电荷守恒还有参加反应,生成H+,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 。③因为通入过量的SO2,SO2会和酸性KMnO4溶液反应,使酸性KMnO4溶液褪色,故不能验证A中发生了氧化还原反应,方案一答案为:否;往第二份试液中加入K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]生成特征蓝色的铁氰化亚铁沉淀,故方案二现象为:生成特征的蓝色沉淀。④酸性高锰酸钾溶液是用硫酸酸化的,向溶液中滴加氯化钡溶液,即使SO2没有被氧化也会产生BaSO4白色沉淀,故该方案不妥之处为:高锰酸钾用硫酸酸化。
,根据得失电子守恒和电荷守恒还有参加反应,生成H+,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 。③因为通入过量的SO2,SO2会和酸性KMnO4溶液反应,使酸性KMnO4溶液褪色,故不能验证A中发生了氧化还原反应,方案一答案为:否;往第二份试液中加入K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]生成特征蓝色的铁氰化亚铁沉淀,故方案二现象为:生成特征的蓝色沉淀。④酸性高锰酸钾溶液是用硫酸酸化的,向溶液中滴加氯化钡溶液,即使SO2没有被氧化也会产生BaSO4白色沉淀,故该方案不妥之处为:高锰酸钾用硫酸酸化。
(2)根据化学方程式:I2+SO2+2H2O=2HI+H2SO4,可得关系:I2~SO2,由题意:n(SO2)=c×(VV0)×103mol,所以该葡萄酒中SO2含量为:c×(VV0)×103mol×64g/mol÷( 5×102L)=![]() g/L。
g/L。








