题目内容
【题目】ⅥA族元素形成的化合物在实验室和工业生产上有着广泛的应用。回答下列问题:
(1)SCN-与Fe3+可形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使Fe3+的剩余价电子压缩配对,则每个配离子中Fe3+的单电子个数为_________个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式_____________。H2Se的酸性比H2S________(填“强”或“弱”)。H2O、H2S、H2Se沸点由高到低的顺序为__________________,原因是:___________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为_______,其VSEPR构型为_____________。
(4)已知S4O62-的结构为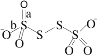 ,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
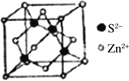
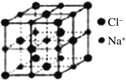
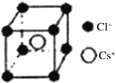
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为M g/mol,则阳离子配位数为___________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
【答案】1 [Ar]3d104s24p4 强 H2O> H2Se> H2S 原因:H2O分子间可以形成较多氢键,而H2Se和H2S分子间不形成氢键;H2Se的相对分子质量比H2S大,范德华力较大 OF2 四面体形 sp3杂化 < 4 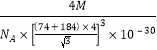
【解析】
(1)[Fe(SCN)6]3-中的铁为+3价,剩余价电子为![]() ,单电子为5个,SCN-会使铁的剩余价电子压缩配对:
,单电子为5个,SCN-会使铁的剩余价电子压缩配对:![]() ;
;
(2)元素Se处于第四周期VIA族,原子序数为34,根据构造原理,书写其核外电子排布式;氢化物中共价键越弱,越容易电离产生H+,溶液的酸性越强;根据分子间作用力与相对分子质量大小的关系判断熔沸点,同时要结合氢键判断;
(3)原子总数相等、价电子总数也相等的微粒互为等电子体,利用原子替换书写,同主族元素原子价电子数目相等;利用价层电子对数判断其VSEPR构型;
(4)S4O62-的结构中两边的S原子均形成4个σ键且无孤对电子,中间的两个S原子均形成两个单键,且均有两对孤对电子;原子间形成的共价键数目越大,键长就越短;
(5)先根据晶体中阳离子与阳离子半径大小计算半径比,判断其所属构型,然后判断晶胞中含有的各种离子的个数,结合摩尔质量计算晶胞中微粒总质量,阴阳离子半径之和为体对角线的![]() 且体对角线为晶胞边长的
且体对角线为晶胞边长的![]() 倍,结合晶胞密度公式计算。
倍,结合晶胞密度公式计算。
(1)[Fe(SCN)6]3-中的铁为+3价,剩余价电子为![]() ,单电子为5个,由于SCN-会使铁的剩余价电子压缩配对:
,单电子为5个,由于SCN-会使铁的剩余价电子压缩配对:![]() ,所以每个配离子中铁的单电子个数为1个;
,所以每个配离子中铁的单电子个数为1个;
(2)元素Se处于第四周期VIA族,原子序数为34,基态电子排布为1s22s22p63s23p63d104s24p4;在H2S、H2Se分子中,S、Se是同一主族的元素,由于元素的非金属性S>Se,元素的非金属性越强,共价键越不容易断裂,所以H-Se键比H-S容易断裂,因此H2Se的酸性比H2S 的强;
H2O、H2S、H2Se都是由分子构成的物质,由于H2O的分子间存在氢键,增加了分子之间的吸引力,所以H2O的沸点最高;H2S、H2Se结构相似,对于结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点就越高。由于相对分子质量H2S<H2Se,所以沸点:H2S<H2Se,故H2O、H2S、H2Se沸点由高到低的顺序为H2O>H2Se>H2S;
(3)利用原子替换,同主族元素原子价电子数目相等,前1~9号元素形成的物质中,只有OF2与SCl2互为等电子体;OF2的中心原子价层电子对数为2+![]() =4,所以其VSEPR构型为四面体形;
=4,所以其VSEPR构型为四面体形;
(4)S4O62-的结构中两边的S原子均形成4个σ键且无孤对电子,所以均为sp3杂化,中间的两个S原子均形成两个单键,且均有两对孤对电子,也是sp3杂化,所以均为sp3杂化。由于原子间形成的共价键数目越大,原子间结合力就越强,该化学键的键长就越短。A键是S=O双键,b键是S-O单键,所以键长a<b;
(5)根据74÷184≈0.402可知离子晶体RA的晶胞为立方ZnS型,由晶胞构型可以看出阴离子的配位数为4,由于阴阳离子个数比为1:1,所以阳离子的配位数为4。1个晶胞含有4个RA,晶胞中微粒总质量=![]() g,阴阳离子半径之和为体对角线的
g,阴阳离子半径之和为体对角线的![]() 且体对角线为晶胞边长的
且体对角线为晶胞边长的![]() 倍,则晶体密度ρ=
倍,则晶体密度ρ=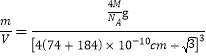 =
=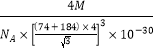 g/cm3。
g/cm3。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】化学反应原理知识在指导工业生产和环保等方面具有重要作用,请回答下列问题:
(1)已知热化学方程式:
①2C(s)+H2(g) = C2H2(g) △H1
②C(s)+O2(g) = CO2(g) △H2
③H2(g) +![]() O2(g) = H2O(l) △H3
O2(g) = H2O(l) △H3
则表示C2H2燃烧热的热化学方程式为____________________________。
(2)利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 40 |
压强/kPa | 20.0 | 19.5 | 18.3 | 16.0 | 16.0 | 16.0 | 22.0 |
①平衡时,SO2的转化率α= _________ %;
②T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
③下图分别代表焓变(△H)、混合气体平均相对分子(![]() )、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
)、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
A  B
B 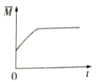 C
C  D
D 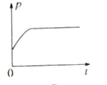
④40min时,改变的条件可能是_______________________________(写2点)。
(3)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结构如图所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量/mol | 0.025 | 0.5 | 9.475 | n |
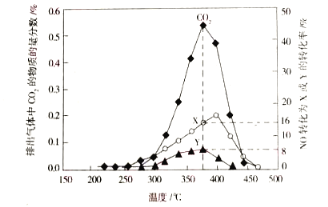
①二氧化碳的电子式为__________________。
②375℃时,测得排出的气体中含0.45molO2和0.0525molCO2,则Y的化学名称为______。