题目内容
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池如图所示,电池总反应为:
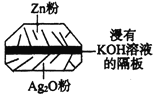
Zn + Ag2O + H2O = 2Ag + Zn(OH)2。下列叙述中正确的是( )
A.在使用过程中,电解质KOH不断被消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.正极反应式为:Ag2O+H2O+2e- = 2Ag+2OH-
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
【答案】C
【解析】
A选项,根据总反应方程式得出在使用过程中,电解质KOH没有被消耗,故A错误;
B选项,使用过程中,电子由Zn极经外电路流向Ag2O极,故B错误;
C选项,根据总反应,锌化合价升高,氧化银化合价降低,得到电子,因此正极反应式为:Ag2O+H2O+2e- = 2Ag+2OH-,故C正确;
D选项,Zn电极发生氧化反应,Ag2O电极发生还原反应,故D错误。
综上所述,答案为C。

练习册系列答案
相关题目