题目内容
4.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 5.6 g Fe与足量稀HNO3发生反应,转移的电子数为0.3 NA | |
| B. | 在1 L 0.1 mol/L AlCl3溶液中含有0.1 NA 个Al3+ | |
| C. | 在某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应后,可得0.2NA个NH3分子 | |
| D. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的个数为2NA |
分析 A、求出铁的物质的量,然后根据铁与稀硝酸反应后变为+3价来分析;
B、铝离子是弱碱阳离子,在溶液中会水解;
C、合成氨的反应为可逆反应;
D、标况下,四氯化碳为液体.
解答 解:A、5.6g铁的物质的量为0.1mol,而铁与稀硝酸反应后变为+3价,故0.1mol铁失去0.3mol电子即0.3NA个,故A正确;
B、铝离子是弱碱阳离子,在溶液中会水解,故溶液中的铝离子的个数小于0.1NA个,故B错误;
C、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子的个数小于0.2NA个,故C错误.
D、标况下,四氯化碳为液体,其物质的量不能根据气体摩尔体积来计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,熟练掌握公式的运用和物质的结构是解题关键.

练习册系列答案
相关题目
14.下列叙述正确的是( )
| A. | 同主族金属元素的原子半径越大,熔点越高 | |
| B. | 离子晶体固态或熔融状态下都能导电 | |
| C. | 原子最外层有3个电子的元素一定是主族元素 | |
| D. | 温度越高,金属晶体的导电性越好 |
19.不能说明氯元素的非金属性比硫元素强的事实是( )
| A. | Cl2与H2S溶液发生置换反应 | B. | 受热时H2S能分解,HCl则不能 | ||
| C. | 单质硫可在空气中燃烧,Cl2不能 | D. | 溶于水时HCl是强酸,H2S是弱酸 |
9.某同学用以下装置制备并检验Cl2的性质.下列说法正确的是( )
| A. |  如图:若浓盐酸过量,则理论上MnO2可全部消耗完 | |
| B. |  如图:证明新制氯水只具有酸性 | |
| C. | 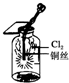 如图:产生了棕黄色的雾 | |
| D. | 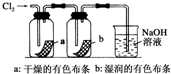 如图:湿润的有色布条褪色,说明氯气具有漂白性 |
14.如图所示的反应过程中,关于乙烯所发生的反应类型的叙述正确的是( )
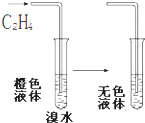

| A. | 氧化反应 | B. | 还原反应 | C. | 取代反应 | D. | 加成反应 |
 (一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).
(一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).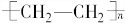 .
.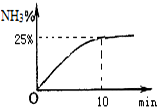 目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.