题目内容
16.在标准状况下,由CO和CO2组成的混合气体4.48L,质量是8g.此混合物中CO和CO2的物质的量比是1:3,CO的体积分数是25%,CO的质量分数是17.5%,混合气体中C和O的原子个数比是4:7,混合气体的平均摩尔质量是40g/mol.分析 计算混合气体物质的量,根据总质量、总物质的量列方程计算CO和CO2,根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,令CO和CO2的物质的量分别为xmol、ymol,根据二者物质的量及质量列方程计算x、y的值,可得二者物质的量之比;利用$\frac{CO的物质的量}{总物质的量}$计算CO的体积分数,根据m=nM计算CO的质量,再利用$\frac{CO的质量}{总质量}$×100%计算CO的质量分数,计算C原子、O原子的物质的量,据此判断C原子与O原子数目之比;根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量.
解答 解:标况下CO和CO2组成的混合气体4.48L,物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,
令CO和CO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.2}\\{28x+44y=8}\end{array}\right.$
解得:x=0.05,y=0.15
混合物中CO和CO2的物质的量比为0.05mol:0.15mol=1:3,
CO的体积分数为$\frac{0.05mol}{0.2mol}$=25%,
CO的质量为0.05mol×28g/mol=1.4g,故CO的质量分数为$\frac{1.4g}{8g}$×100%=17.5%,
CO2的物质的量分别为0.15mol-0.05mol=0.1mol,所以混合气体中C和O两种原子的数目之比为(0.05mol+0.15mol):(0.05mol+2×0.15mol)=4:7,
混合气体平均摩尔质量为$\frac{8g}{0.2mol}$=40g/mol,
故答案为:1:3;25%;7.5%;4:7;40g/mol.
点评 本题考查物质的量的相关计算,题目难度不大,侧重对基础知识的巩固.

| A. | 5.6 g Fe与足量稀HNO3发生反应,转移的电子数为0.3 NA | |
| B. | 在1 L 0.1 mol/L AlCl3溶液中含有0.1 NA 个Al3+ | |
| C. | 在某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应后,可得0.2NA个NH3分子 | |
| D. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的个数为2NA |
| A. | 实验剩余的药品不能放回原试剂瓶 | B. | 可燃性气体的验纯 | ||
| C. | 不能给正燃烧着的酒精灯添加酒精 | D. | 滴管不能交叉使用 |
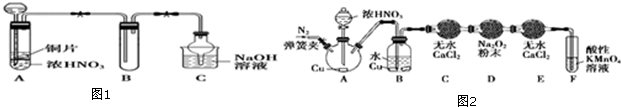
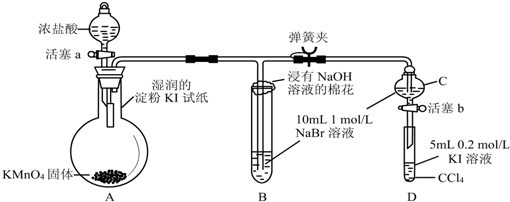
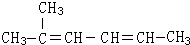 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.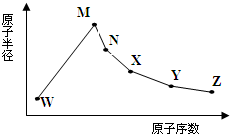 W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.
W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.