题目内容
【题目】亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)=_____________(用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8(mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq)![]() AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为____________。
㈡NaNO2性质探究
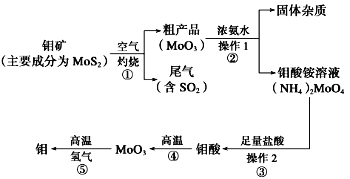
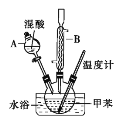
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
已知: 气体液化的温度:NO221℃ 、 NO –152℃
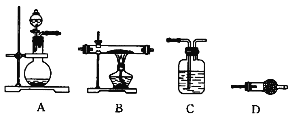
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→______→ ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
【答案】NO2-+H2O![]() HNO2+OH- c(OH-)-c(H+) 111.1 5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O D E C B 检验装置的气密性 打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO ;若无红棕色气体出现,则不含NO 冷凝,使NO2完全液化 4NO2+O2+4NaOH=4NaNO3+2H2O
HNO2+OH- c(OH-)-c(H+) 111.1 5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O D E C B 检验装置的气密性 打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO ;若无红棕色气体出现,则不含NO 冷凝,使NO2完全液化 4NO2+O2+4NaOH=4NaNO3+2H2O
【解析】
(一)(1)NaNO2溶液显示碱性,NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;根据亚硝酸钠溶液中的质子守恒分析;
(2)写出该反应的平衡常数表达式,然后根据Ksp(AgNO2)、Ksp(AgCl)进行计算;
(3)酸性高锰酸钾具有强氧化性,将亚硝酸根离子氧化成硝酸根离子;
(二)(1)根据各部分装置的作用进行连接;
(3)①根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断;
②温度低于二氧化氮液化温度时,二氧化氮变成液态;
③氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水。
(一)(1)由于NaNO2溶液显示碱性,说明NaNO2为强碱弱酸盐,NO2-在溶液中存在水解平衡,NO2-+H2O![]() HNO2+OH-;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+)。
HNO2+OH-;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+)。
(2)反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=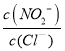 ,根据Ksp(AgCl)=c(Cl-)×c(Ag+)、Ksp(AgNO2)=c(NO2-)×c(Ag+)可知,K=
,根据Ksp(AgCl)=c(Cl-)×c(Ag+)、Ksp(AgNO2)=c(NO2-)×c(Ag+)可知,K= 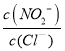 =
=![]() =
=![]() =111.1;
=111.1;
(3)酸性高锰酸钾具有强氧化性,能够将亚硝酸钠氧化成硝酸钠,根据得失电子守恒和原子守恒配平,反应的离子方程式为5NO2-+ 2MnO4-+ 6H+ = 5NO3-+ 2Mn2+ + 3H2O;
(二)(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用检验NO,所以装置的连接为:A→D→E→C→B;组装好仪器后,接下来进行的操作实验是检查装置气密性。
(3)①确认A中产生气体是否含有NO的方法为:打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO;若无红棕色气体出现,则不含NO。
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,所以装置E的作用是冷凝使NO2完全液化。
③如果向D中通入过量O2,则装置B中二氧化氮、氧气和氢氧化钠反应生成硝酸钠和水,其反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
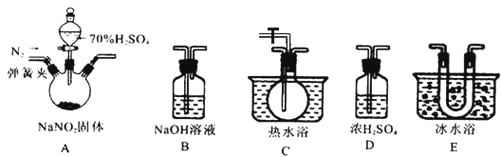
孟建平错题本系列答案【题目】邻硝基甲苯和对硝基甲苯能被用作爆炸品检测的示踪剂。某探究小组利用下图反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:
①按体积比1∶3配制浓硫酸与浓硝酸的混合物80mL;②在250mL的三颈烧瓶中加入30mL(26g)甲苯,按图所示装好药品和其他仪器;③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);④控制温度约为50℃,反应大约10min,三颈烧瓶底有大量淡黄色油状液体出现;⑤分离出一硝基甲苯的总质量为27.20g。
请回答下列问题:
(1)使用仪器A前必须进行的操作是_______。
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、_______。
(3)配制混酸的方法是分别量取20mL浓硫酸和60mL浓硝酸,将浓_______倒入烧杯中,浓_______沿着烧杯内壁缓缓注入,并不断搅拌。
(4)控制温度约为50℃时,反应生成的产物一硝基甲苯是邻硝基甲苯和对硝基甲苯混合物,写出该反应生成对硝基甲苯的化学方程式_______。
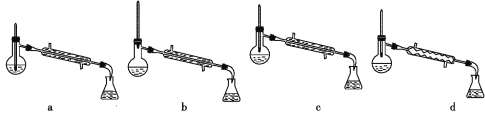
(5)分离反应后产物的方案如下:

①操作1的名称为_______。
②操作2中,下列仪器选择及安装正确的是_______(填字母)。
(6)该实验中一硝基甲苯的产率为_______(保留两位有效数字)。
【题目】下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑧ | ⑩ | |||||
三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
四 | ② | ④ |
(1)在这10种元素中,化学性质最不活泼的元素是________ (写序号),得电子能力最强的原子是________ (用元素符号表示);元素⑦的最高价氧化物对应的水化物是________________ (写化学式)。
(2)元素④的离子结构示意图为________________。
(3span>)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示) ________________。
(4)请写出:
(i)③的单质置换出⑥的单质的化学方程式: ________________________。
(ii)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为____________________。
(iii)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为____________________。