题目内容
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
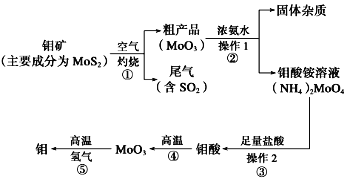
(1)写出在高温下发生反应①的化学方程式______________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:________________________________
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_______________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
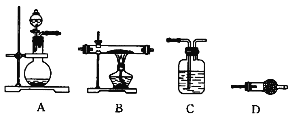
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是___________
② 在烧瓶A中加入少量硫酸铜的目的是____________________________
③ 两次使用D装置,其中所盛的药品依次是____________________、______________________
(5)工业上制备还原性气体CO和H2的反应原理为CO2 + CH4![]() 2CO + 2H2 CH4 + H2O
2CO + 2H2 CH4 + H2O![]() CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
【答案】2MoS2 + 7O2![]() 2MoO3 + 4SO2 SO2 + 2NH3·H2O=== 2NH4+ + SO32-+ H2O 烧杯、漏斗、玻璃棒 ACBDD 加快反应速率 无水硫酸铜 碱石灰 4.11a g
2MoO3 + 4SO2 SO2 + 2NH3·H2O=== 2NH4+ + SO32-+ H2O 烧杯、漏斗、玻璃棒 ACBDD 加快反应速率 无水硫酸铜 碱石灰 4.11a g
【解析】
根据流程图分析主要反应和主要操作,完成化学方程式、选择所需仪器。根据实验目的,设计相关实验,并防止空气的影响。根据化学反应计量关系,进行有关计算。
(1)据流程图找出反应①的反应物、生成物,并用化合价升降法配平,得2MoS2 + 7O2![]() 2MoO3 + 4SO2;
2MoO3 + 4SO2;
(2)足量的浓氨水吸收SO2生成正盐,离子方程式为SO2 + 2NH3·H2O= 2NH4+ + SO32-+ H2O;
(3)步骤②得固体和溶液,操作1为过滤。步骤③复分解反应能进行,则钼酸难溶于水,操作2为过滤。需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒;
(4)①制备H2并还原MoO3可证明其还原性,用无水硫酸铜检验氧化产物水,必须对氢气干燥,并防止空气中水汽干扰。故装置连接顺序是ACBDD。
②在烧瓶A中加入少量硫酸铜,可形成原电池,加快生成氢气的速率。
③第一次使用D装置,所盛药品为无水硫酸铜,用于检验氧化产物水。第二次使用D装置,所盛药品为碱石灰等,防止空气中的水汽使无水硫酸铜变蓝。
(5)据CO2 + CH4![]() 2CO + 2H2、CH4 + H2O
2CO + 2H2、CH4 + H2O![]() CO + 3H2,当二氧化碳和水蒸气足量时,CH4 ~ 4(CO + H2);又据MoO3 +3CO=Mo +3CO2、MoO3 +3H2=Mo +3H2O,有3(CO + H2) ~ Mo,故3CH4 ~ 4Mo。则m(Mo)=
CO + 3H2,当二氧化碳和水蒸气足量时,CH4 ~ 4(CO + H2);又据MoO3 +3CO=Mo +3CO2、MoO3 +3H2=Mo +3H2O,有3(CO + H2) ~ Mo,故3CH4 ~ 4Mo。则m(Mo)=![]() ×80%×90%×
×80%×90%×![]() ×96g·mol-1=4.11a g。
×96g·mol-1=4.11a g。