题目内容
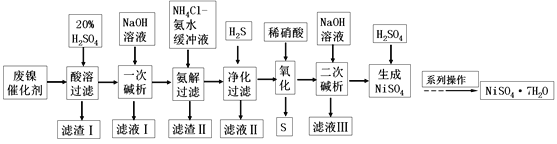
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
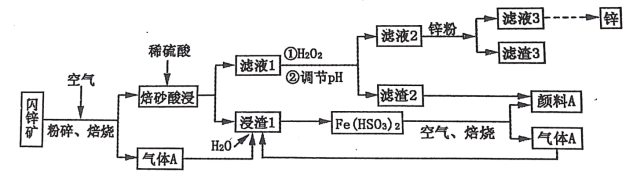
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
【答案】增大固体不氧气的接触面积,提高反应速率。 将Fe2+完全氧化成Fe3+,避免引入杂质 3 Zn和Cu或者Cu 取少量固体A于试管中,加入稀硫酸完全溶解后,滴加酸性KMnO4紫红色褪色,则含有Fe2+ 4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4
【解析】
(1)闪锌矿粉碎的目的是增大固体不氧气的接触面积,提高反应速率。
(2)“滤液 1”中选用足量的 H2O2,理由是将 Fe2+完全氧化成 Fe3+,避免引入杂质。假设“②调节 pH前,滤液1中 c(Fe3+)=1molL-1 ,则Fe3+完全沉淀时,![]() ,
,![]() ,
,![]() ,pH = 3。
,pH = 3。
(3)由于滤液2中加入锌粉,其主要是将铜离子置换出来,锌可能可能,因此“滤渣3”的成分为Zn和Cu或者Cu。
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案,主要将固体A溶于稀硫酸中,再用酸性高锰酸钾来验证亚铁离子。
(5)气体A为二氧化硫与浸渣1的ZnFeO4反应的化学方程式为4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4。
(1)闪锌矿粉碎的目的是增大固体不氧气的接触面积,提高反应速率,故答案为:增大固体不氧气的接触面积,提高反应速率。
(2)“滤液 1”中选用足量的 H2O2,理由是将 Fe2+完全氧化成 Fe3+,避免引入杂质。假设“②调节 pH前,滤液1中 c(Fe3+)=1molL-1 ,则Fe3+完全沉淀时,![]() ,
,![]() ,
,![]() ,pH = 3,故答案为:将Fe2+完全氧化成Fe3+,避免引入杂质;3。
,pH = 3,故答案为:将Fe2+完全氧化成Fe3+,避免引入杂质;3。
(3)由于滤液2中加入锌粉,其主要是将铜离子置换出来,锌可能可能,因此“滤渣3”的成分为Zn和Cu或者Cu,故答案为:Zn和Cu或者Cu。
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案,主要将固体A溶于稀硫酸中,再用酸性高锰酸钾来验证亚铁离子,故答案为:取少量固体A于试管中,加入稀硫酸完全溶解后,滴加酸性KMnO4紫红色褪色,则含有Fe2+。
(5)气体A为二氧化硫与浸渣1的ZnFeO4反应的化学方程式为4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4,故答案为:4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4
。

 名校课堂系列答案
名校课堂系列答案【题目】已知几种化学键的键能和热化学方程式如下:
化学键 | H—N | N—N | Cl—Cl | N | H—Cl |
键能/(kJ·mol-1) | 391 | 193 | 243 | 946 | 432 |
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是( )
A.H(g)+Cl(g)=HCl(g) ΔH=+432kJ·mol-1
B.断裂1molCl—Cl键吸收能量比断裂1molN![]() N键多703kJ
N键多703kJ
C.上述反应中,ΔH=-431kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
【题目】相同温度下,根据三种酸的电离平衡常数,下列判断正确的是![]()
酸 | HX | HY | HZ |
|
|
|
|
A.三种酸的强弱关系: ![]()
B.反应 ![]() 能够发生
能够发生
C.相同温度下,![]() 的NaX、NaY、NaZ溶液,NaZ溶液pH最大
的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,![]() 溶液的电离常数大于
溶液的电离常数大于![]()