题目内容
(12分)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ⊿H
CH3OH(g) ⊿H
已知某些化学键的键能数据如下表:
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为 。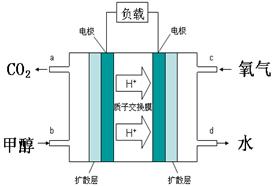
 CH3OH(g) ⊿H
CH3OH(g) ⊿H已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡的是 ;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为 。

(12分) (1) -116 kJ·mol-1 (2) 0.0125 mol·L-1·min-1 , 4 , 减小
(3)AC (4) 2 CH3OH-12e-+2H2O=2CO2+12H+
(3)AC (4) 2 CH3OH-12e-+2H2O=2CO2+12H+
(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据反应式可知,该反应的△H=1072kJ·mol+2×436kJ·mol-3×412kJ·mol-358kJ·mol-463kJ·mol=-116kJ·mol.
(2) CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始量(mol) 1 2 0
转化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
所以有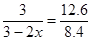
解得x=0.5
CO表示的平均反应速率是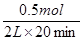 =0.0125 mol·L-1·min-1。该温度下平衡常数K=
=0.0125 mol·L-1·min-1。该温度下平衡常数K=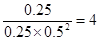 ;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以A可以说明;B中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明;反应是体积减小的,所以压强也是减小的,C可以说明;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,答案选AC。
(4)原电池中负极失去电子,所以甲醇在负极通入。由于质子交换膜只能允许氢离子通过,所以负极电极反应式是2 CH3OH-12e-+2H2O=2CO2+12H+。
(2) CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)起始量(mol) 1 2 0
转化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
所以有
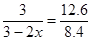
解得x=0.5
CO表示的平均反应速率是
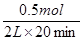 =0.0125 mol·L-1·min-1。该温度下平衡常数K=
=0.0125 mol·L-1·min-1。该温度下平衡常数K=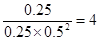 ;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。
;正反应是放热反应,所以升高温度,平衡向逆反应方向进行,平衡常数减小。(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以A可以说明;B中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明;反应是体积减小的,所以压强也是减小的,C可以说明;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确,答案选AC。
(4)原电池中负极失去电子,所以甲醇在负极通入。由于质子交换膜只能允许氢离子通过,所以负极电极反应式是2 CH3OH-12e-+2H2O=2CO2+12H+。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:

 N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O
N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O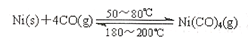

 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 。
 2C(g) ΔH<0,(Ⅱ)3A(g)
2C(g) ΔH<0,(Ⅱ)3A(g)