题目内容
在密闭容器中发生下列反应:(Ⅰ)2A(g)+B(g)  2C(g) ΔH<0,(Ⅱ)3A(g)
2C(g) ΔH<0,(Ⅱ)3A(g)  D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是
D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是
①缩小容器容积 ②升高温度 ③增加A的浓度
 2C(g) ΔH<0,(Ⅱ)3A(g)
2C(g) ΔH<0,(Ⅱ)3A(g)  D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是
D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是①缩小容器容积 ②升高温度 ③增加A的浓度
| A.仅① | B.①③ | C.①②③ | D.都不能 |
A
(Ⅰ)为体积减小的放热反应;(Ⅱ)体积减小的吸热反应。故缩小体积可行。增加A的浓度平衡正向移动,但转化率减小。

练习册系列答案
相关题目
 CH3OH(g) ⊿H
CH3OH(g) ⊿H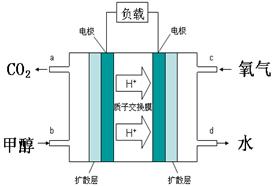
 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。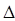 H<0,
H<0, S>0的化学反应一定能自发进行
S>0的化学反应一定能自发进行