��Ŀ����
(13��)��Ҫ��������и�С�⡣
(1)��CO2������ȼ�ϼ״��ķ�Ӧԭ����CO2(g)+3H2(g) CH3OH(g)+H2O(g)��ijЩ��ѧ���ļ����������±���
CH3OH(g)+H2O(g)��ijЩ��ѧ���ļ����������±���
���㷴Ӧ������Ӧ���ʱ��H=_______________________
д��������Ӧ��ƽ�ⳣ������ʽK=__________________���������¶ȣ���ƽ�ⳣ��K________(�����С�����䡱)���÷�Ӧ�ġ�S______0(�>����<����=��)���� _________(��ϸߡ��ϵ͡�)�¶��������ڸ÷�Ӧ�Է����С�
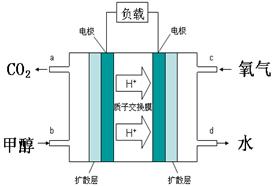
(2)��25���£���Ũ�Ⱦ�Ϊ0��01 mol?L-1��MgCl2��AlCl3�����Һ����μ��백ˮ��������__________����(�ѧʽ)�����ɸó��������ӷ���ʽΪ________________��
����֪25��ʱKsp[Mg(OH)2]=1.8��10-11��Ksp[Al(OH)3]=3��10-34����
(3)ij�¶�(t��)ʱ�����0.01mol��L-1��NaOH��Һ��pH��11���ڴ��¶��£���pH��2��H2SO4��ҺVaL��pH��12��NaOH��ҺVbL��ϣ������û��ҺΪ���ԣ���Va�UVb�� ��
(4)��25��ʱ����cmol��L-1�Ĵ�����Һ��0.02mol��L-1NaOH��Һ�������Ϻ���Һ�պó����ԣ��ú�c�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��Ka=____________________��
(1)��CO2������ȼ�ϼ״��ķ�Ӧԭ����CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)��ijЩ��ѧ���ļ����������±���
CH3OH(g)+H2O(g)��ijЩ��ѧ���ļ����������±���| ��ѧ�� | C��C | C��H | H��H | C��O | C=O | H��O |
| ����/kJ��mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
д��������Ӧ��ƽ�ⳣ������ʽK=__________________���������¶ȣ���ƽ�ⳣ��K________(�����С�����䡱)���÷�Ӧ�ġ�S______0(�>����<����=��)���� _________(��ϸߡ��ϵ͡�)�¶��������ڸ÷�Ӧ�Է����С�
(2)��25���£���Ũ�Ⱦ�Ϊ0��01 mol?L-1��MgCl2��AlCl3�����Һ����μ��백ˮ��������__________����(�ѧʽ)�����ɸó��������ӷ���ʽΪ________________��
����֪25��ʱKsp[Mg(OH)2]=1.8��10-11��Ksp[Al(OH)3]=3��10-34����
(3)ij�¶�(t��)ʱ�����0.01mol��L-1��NaOH��Һ��pH��11���ڴ��¶��£���pH��2��H2SO4��ҺVaL��pH��12��NaOH��ҺVbL��ϣ������û��ҺΪ���ԣ���Va�UVb�� ��
(4)��25��ʱ����cmol��L-1�Ĵ�����Һ��0.02mol��L-1NaOH��Һ�������Ϻ���Һ�պó����ԣ��ú�c�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��Ka=____________________��
��13�֣�
(1) -178 kJ��mol-1 (2��)��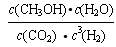 (1��)����С(1��)��<(1��)���ϵ�(1��)
(1��)����С(1��)��<(1��)���ϵ�(1��)
(2)Al(OH)3(1��) Al3++3NH3��H2O==Al(OH)3��+3NH4+ (2��)
(3)10:1 (2��)
(4)2��10��9/(c��0.02) (2��)
(1) -178 kJ��mol-1 (2��)��
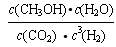 (1��)����С(1��)��<(1��)���ϵ�(1��)
(1��)����С(1��)��<(1��)���ϵ�(1��) (2)Al(OH)3(1��) Al3++3NH3��H2O==Al(OH)3��+3NH4+ (2��)
(3)10:1 (2��)
(4)2��10��9/(c��0.02) (2��)
�����������1����Ӧ�Ⱦ��Ƕϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ�����Ը��ݼ��ܿ�֪���÷�Ӧ�ķ�Ӧ���ǡ�H��750kJ/mol��2��436kJ/mol��3��413kJ/mol3��463kJ/mol��3��358kJ/mol����178kJ/mol����ѧ��������һ�������µĿ��淴Ӧ�У������淴Ӧ��Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��ݷ�Ӧ�ķ���ʽ��֪���÷�Ӧ��ƽ�ⳣ����K��
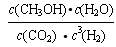 ������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С�����ݷ���ʽ��֪������Ӧ�������С�ģ����ԡ�SС��0�����ݡ�G����H��T����S��֪��Ҫʹ��Ӧ���Է��ģ����G����С��0�����Է�Ӧ�ڽϵ͵��¶������Է��ġ�
������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С�����ݷ���ʽ��֪������Ӧ�������С�ģ����ԡ�SС��0�����ݡ�G����H��T����S��֪��Ҫʹ��Ӧ���Է��ģ����G����С��0�����Է�Ӧ�ڽϵ͵��¶������Է��ġ���2�������ܶȻ������ı���ʽ��֪������������þ����ʱ��Ҫ��OH��Ũ����
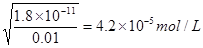 ��ͬ����֪����������������ʱ��Ҫ��OH��Ũ����
��ͬ����֪����������������ʱ��Ҫ��OH��Ũ����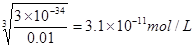 �������������ɵ�������������������Ӧ�����ӷ���ʽ��Al3++3NH3��H2O==Al(OH)3��+3NH4+��
�������������ɵ�������������������Ӧ�����ӷ���ʽ��Al3++3NH3��H2O==Al(OH)3��+3NH4+����3��0.01mol��L-1��NaOH��Һ��pH��11��������Һ��������Ũ����1��10��11mol/L����OH��Ũ����0.01mol/L������¶���ˮ�����ӻ�����Kw=10
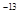 ��pH��2��H2SO4��ҺVaL��pH��12��NaOH��ҺVbL��ϣ������û��ҺΪ���ԣ���
��pH��2��H2SO4��ҺVaL��pH��12��NaOH��ҺVbL��ϣ������û��ҺΪ���ԣ���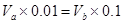 ������Va�UVb��10:1��
������Va�UVb��10:1����4��cmol��L-1�Ĵ�����Һ��0.02mol��L-1NaOH��Һ�������Ϻ���Һ�պó����ԣ����Ը��ݵ���غ��֪
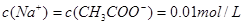 ������Һ��������Ũ����1��10��7mol/L.���������غ��֪����Һ�д����Ũ����0.5c��0.01�����Ը��¶��´���ĵ��볣��Ka=
������Һ��������Ũ����1��10��7mol/L.���������غ��֪����Һ�д����Ũ����0.5c��0.01�����Ը��¶��´���ĵ��볣��Ka=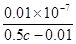 ��2��10��9/(c��0.02)��
��2��10��9/(c��0.02)��������������ˮ�����ӻ����������йؼ���ʱ������ע��ˮ�����ӻ��������¶��й�ϵ�����ڵ��������ȵģ�����ˮ�����ӻ��������¶ȵ����߶�����ֻ���ڳ��³�ѹ��pH��7����Һ���������Եģ�ͬ��ƽ�ⳣ�����ܶȻ������Լ�����ƽ�ⳣ������ֻ���¶��й�ϵ�ģ������ڴﵽƽ��״̬��Ӧ�ij����������ڽ����йؼ�����Ҫ�ر�ע�⡣

��ϰ��ϵ�д�
�����Ŀ

 N2O4(g)�ﵽƽ��ʱNO2���������
N2O4(g)�ﵽƽ��ʱNO2���������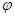 (NO2)��ѹǿP�ı仯��ͼ����ʾ����A�����ɫ�B�����ɫdz
(NO2)��ѹǿP�ı仯��ͼ����ʾ����A�����ɫ�B�����ɫdz ������
������ 2C(g)��ƽ����£���ѹ��ƽ�������ƶ���ƽ�ⳣ��Kֵ����
2C(g)��ƽ����£���ѹ��ƽ�������ƶ���ƽ�ⳣ��Kֵ����
 CH3OH(g) �SH
CH3OH(g) �SH