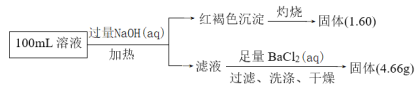
题目内容
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
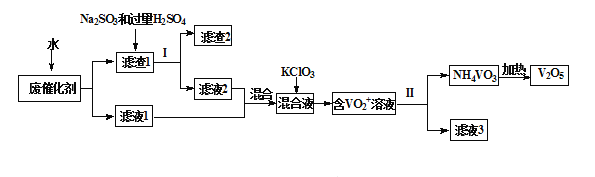
已知:a.部分含钒物质常温下在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
b.![]() +2OH-
+2OH-![]()
![]() +H2O
+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为_________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为_______________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为_____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为________________
(5)结合化学用语,用平衡移动原理解释加入氨水的一种作用为__________________
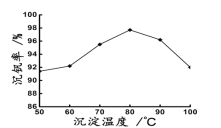
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是________________________;___________________(写两条)。
(7)该工艺流程中可以循环利用的物质为__________________。
(8)测定产品中V2O5的纯度:称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol1)的质量分数是______。(列出计算式)
【答案】粉碎废钒搅拌适当升温 VO2+ V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O 6VO2++ClO3-+3H2O= 6VO2++Cl-+6H+ 作用1:溶液中存在平衡: VO2++2OH—![]() VO3—+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3- 作用2:溶液中存在平衡: NH4VO3(s)
VO3—+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3- 作用2:溶液中存在平衡: NH4VO3(s) ![]() NH4+ (aq)+ VO3-(aq), 加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降。 原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降。 氨水或NH3和H2O
NH4+ (aq)+ VO3-(aq), 加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降。 原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降。 氨水或NH3和H2O ![]()
【解析】
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以用搅拌、粉碎的方式来增大固体与液体的接触面积,也可以升高温度;
(2)由部分含钒物质常温下在水中的溶解性可知,滤液1溶质为VOSO4;
(3)滤液1和滤液2中钒的存在形式相同,所以V2O5与亚硫酸钠、硫酸反应生成VOSO4;
(4)KClO3与VO2+反应生成V2O5,ClO3-作氧化剂,根据1molKClO3在反应时得到6mol电子,ClO3-被还原为Cl-;
(5)根据勒夏特列原理解释加入氨水的作用;
(6)从NH4VO3的溶解度、以及氨水受热分解的角度分析;
(7)NH4VO3受热分解生成V2O5、氨气、水,故可以循环的物质是氨水;
(8)根据元素化合价升降相等,滴定过程中由5(NH4)2Fe(SO4)2~KMnO4,则过量的(NH4)2Fe(SO4)2物质的量为5n(KMnO4)=5×b2c2×10-3mol,则与(VO2)2SO4溶液反应的(NH4)2Fe(SO4)2物质的量为(b1c1-5×b2c2)×10-3mol,根据钒元素守恒,则与V2O5 ~2VO2+~(NH4)2Fe(SO4)2,故n(V2O5)=5×(b1c1-5×b2c2)×10-4mol,据此计算可得。
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取粉碎废钒、搅拌、适当升温等措施;
(2)由部分含钒物质常温下在水中的溶解性可知,滤液1溶质为VOSO4,滤液1和滤液2中钒的存在形式相同,其存在形式为VO2+;
(3)滤渣1的成分为V2O5、不溶性硅酸盐,因为滤液1和滤液2中钒的存在形式相同,所以滤渣1的成分中的V2O5与与亚硫酸钠、硫酸反应生成VOSO4,发生反应的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O;
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,故ClO3-被还原为Cl-,反应的离子方程式为6VO2++ClO3-+3H2O= 6VO2++Cl-+6H+;
(5)含VO2+的溶液中加入氨水生成NH4VO3,用平衡移动原理解释其作用,作用1![]() VO3-+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,作用2:溶液中存在平衡: NH4VO3(s)
VO3-+H2O,加入氨水,使OH—浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-,作用2:溶液中存在平衡: NH4VO3(s) ![]() NH4+ (aq)+ VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
NH4+ (aq)+ VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
(6)温度超过80℃以后,沉钒率下降的原因:①温度升高,NH4VO3溶解度增大,沉钒率下降;②温度升高,氨水受热分解逸出溶液,氨气在水中的溶解度降低,使NH4+浓度下降,沉钒率下降;
(7)NH4VO3受热分解的方程式为2NH4VO3![]() V2O5+2NH3+H2O,故该工艺流程中可以循环利用的物质为NH3和H2O;
V2O5+2NH3+H2O,故该工艺流程中可以循环利用的物质为NH3和H2O;
(8)根据元素化合价升降相等,滴定过程中由5(NH4)2Fe(SO4)2~KMnO4,则过量的(NH4)2Fe(SO4)2物质的量为5n(KMnO4)=5×b2c2×10-3mol,则与(VO2)2SO4溶液反应的(NH4)2Fe(SO4)2物质的量为(b1c1-5×b2c2)×10-3mol,根据钒元素守恒,则与V2O5 ~2VO2+~(NH4)2Fe(SO4)2,故n(V2O5)=5×(b1c1-5×b2c2)×10-4mol,则产品中V2O5 的质量分数是: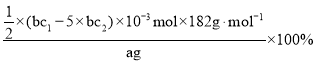 =
=![]() 。
。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
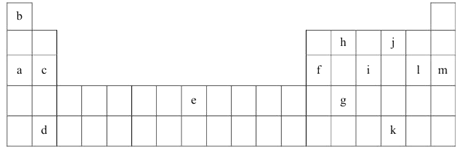
(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
锂 | X | Y | |
第一电离能 | 519 | 502 | 580 |
第二电离能 | 7296 | 4570 | 1820 |
第三电离能 | 11799 | 6920 | 2750 |
第四电离能 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:______________________________________。
②表中的Y可能为以上13种元素中的_________(填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式___________________________。
(3)根据构造原理,用电子排布式表示e的核外电子排布式_______________。
(4)以上13种元素中,________(填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________________。