题目内容
【题目】能源是现代文明的原动力,通过化学方法开辟新能源和提高能量转化率。
请回答下列问题:
(1)已知一定条件下白磷转化为红磷释放出能量,故白磷比红磷稳定性______(填“强”、“弱”)
(2)化学反应的本质是旧的化学键断裂,新的化学键形成。已知断开1molH﹣H键、1molN≡N键、lmolN﹣H键分别需要吸收的能量为436kJ、946kJ、391kJ。那么生成1mo1 NH3需要________(填“放出”或“吸收”)__________kJ 的热量。
(3)化学电源在生产生活中有着广泛的应用。
①为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。
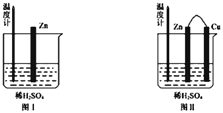
下列说法正确的是___________(填序号)
A.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
B.图Ⅱ中产生气体的速率比Ⅰ快
C.图Ⅰ中温度计的示数高于图Ⅱ的示数
D.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
②燃料电池是一种高效、环境友好的供电装置。以氢气为燃料的电池中,电解质溶液为氢氧化钾溶液,负极的反应式为_______________________,当外电路转移1.2mol电子,消耗的氧气的体积为_____________ L(标准状况下)
【答案】弱 放出 46 BC H2-2e-+2OH-=2H2O 6.72
【解析】
(1)物质能量越高越活泼;
(2)化学反应的焓变△H=反应物总键能-生成物总键能;
(3)①图Ⅰ锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+═Zn2++H2↑;;图Ⅱ该装置构成原电池,Zn易失电子作负极,Cu作正极,正极上氢离子得电子生成氢气,据此分析作答;
②原电池中负极发生氧化反应,正极发生还原反应,并考虑电解质溶液参与电极反应来分析;根据电子转移数与氧气的关系式求出氧气消耗量。
(1)已知一定条件下,白磷转化为红磷释放出能量,红磷能量低,故白磷比红磷稳定性弱,
故答案为:弱;
(2)在反应N2+3H22NH3中,形成2molNH3,需放出的能量为6×391kJ=2346kJ,断裂3molHH键,1molN≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ,该反应为放热反应,放出的热量数值为2346kJ2254kJ=92kJ,根据化学反应热与化学计量数成比例可知,当生成1molNH3时需要放出热量为46kJ,
故答案为:放出;46;
(3)①A. 图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面,A项错误;
B. 构成原电池加快化学反应速率,则图Ⅱ中产生气体的速度比Ⅰ快,B项正确;
C. 图Ⅱ的温度计指示的温度变化不明显,说明化学能没有全部转化为热能,大多数转化为电能,则图Ⅰ中温度计的示数高于图Ⅱ的示数,C项正确;
D. 图Ⅰ稀硫酸和锌的反应是放热反应导致溶液温度逐渐升高,化学能转化为热能,温度高于室温,而图Ⅱ化学能没有全部转化为热能,大多数转化为电能,其温度计指示的温度变化不明显,两图示数不相同,D项错误;
故答案为:BC;
②燃料电池中,负极氢气失电子发生氧化反应,在碱性条件下负极反应式为H2-2e-+2OH-=2H2O;正极电极反应为:O2+2H2O+4e=4OH,根据关系式可知,当外电路转移1.2mol电子,消耗的氧气的体积为![]() =6.72L,故答案为:H2-2e-+2OH-=2H2O;6.72。
=6.72L,故答案为:H2-2e-+2OH-=2H2O;6.72。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案