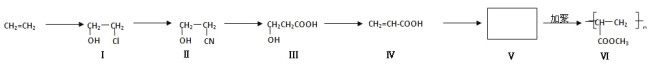
题目内容
【题目】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH的关系图如下所示,下列说法正确的是
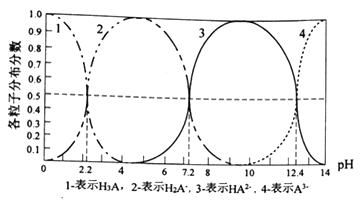
A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+1/2c(HA2-)+1/3c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,c(HA2-)/c(H3A)=100.6
D. 向H3A溶液中加入氨水使pH从5→9发生的主要离子反应是:H2A-+OH-![]() HA2-+H2O
HA2-+H2O
【答案】C
【解析】
从图像可知H3A为弱酸,存在电离平衡,H3A![]() H2A-+H+,Ka1=[c(H2A-)c(H+)]/c(H3A)=10-2.2,H2A-
H2A-+H+,Ka1=[c(H2A-)c(H+)]/c(H3A)=10-2.2,H2A-![]() HA2-+H+ Ka2=[ c(HA2-) c(H+)]/ c(H2A-)=10-7.2,H2A-+H2O
HA2-+H+ Ka2=[ c(HA2-) c(H+)]/ c(H2A-)=10-7.2,H2A-+H2O![]() H3A+OH-水解常数为K= c(H3A) c(OH-)/ c(H2A-),据此分析;
H3A+OH-水解常数为K= c(H3A) c(OH-)/ c(H2A-),据此分析;
水的离子积常数为KW= c(H+) c(OH-)=10-14,所以K= c(H3A) KW/ c(H2A-) c(H+)=KW/ Ka1=10-11.8;Ka2/K=[ c(HA2-)c(H+)]/ c(H2A-)=10-7.2/10-11.8=104.6>1,所以电离大于水解,所以NaH2A水溶液呈酸性,故A项错误;B.HA2-![]() A3-+H+;H2O
A3-+H+;H2O![]() H++OH-,根据质子守恒c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-),故B错误;C.因为Ka1=[c(H2A-)c(H+)]/c(H3A)=10-2.2,Ka2=[ c(HA2-) c(H+)]/ c(H2A-)=10-7.2, Ka1. Ka2=[c(HA2-)C2(H+)]/ c(H3A),(Ka1. Ka2)/ C2(H+)=c(HA2-)/ c(H3A),当溶液至pH=5时,c(H+)=10-5,c(HA2-)/ c(H3A)= (10-2.2 10-7.2)/ 10-10=10-0.6,故C正确;D.因为氨水为弱电解质,所以在离子反应方程式中不能拆,故D错误。综上,本题选C。
H++OH-,根据质子守恒c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-),故B错误;C.因为Ka1=[c(H2A-)c(H+)]/c(H3A)=10-2.2,Ka2=[ c(HA2-) c(H+)]/ c(H2A-)=10-7.2, Ka1. Ka2=[c(HA2-)C2(H+)]/ c(H3A),(Ka1. Ka2)/ C2(H+)=c(HA2-)/ c(H3A),当溶液至pH=5时,c(H+)=10-5,c(HA2-)/ c(H3A)= (10-2.2 10-7.2)/ 10-10=10-0.6,故C正确;D.因为氨水为弱电解质,所以在离子反应方程式中不能拆,故D错误。综上,本题选C。

 阅读快车系列答案
阅读快车系列答案