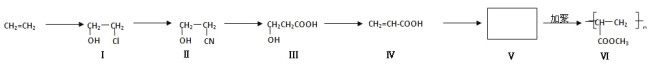
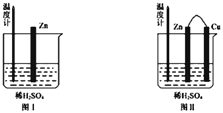
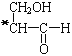题目内容
【题目】下列有关比较正确的是
A. N、O、F最高价依次升高 B. Al3+、K+、F- 微粒半径依次增大
C. 单质的熔点:Cl2>Br2>I2 D. 碱性:CsOH>KOH>NaOH
【答案】D
【解析】
A.因O、F无正价,故A错误;
B.K+核外有三个电子层,Al3+、F-核个只有两个电子层,K+半径较Al3+、F-要大,故B错误;
C.因相对分子质量Cl2<Br2<I2,故分子间的作用力Cl2<Br2<I2,其熔点Cl2<Br2<I2,故C错误;
D.同一主族的元素自上而下,元素的金属性逐渐增强,其最高价氧化物对应水化物的碱性也越强,即CsOH>KOH>NaOH,故D正确;
答案选D。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中的位置 。
(2)实验室制取X元素的氢化物的化学方程式为 。
(3)W、Z的最高价氧化物对应的含氧酸的酸性大小顺序 (用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为 。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为 。