题目内容
【题目】工业上用铬铁矿(FeO、Cr2O3、含SiO2、Al2O3杂质)生产红矾钠(Na2Cr2O7)的工艺流程如下:
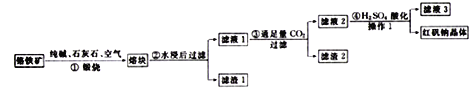
(1)上述四个步骤中,有氧化还原反应发生的是________(填序号),被氧化的元素是______(写元素符号)。
(2)滤渣1的主要成分是________(写化学式),写出步骤③发生反应的离子方程式___________________。
(3)操作1包括______、________、过滤、洗涤、干燥。
(4)向橙红色的红钒钠溶液中滴入氨氧化钠溶液,变为黄色Na2CrO4溶液,写出该转化过程的离子方程式______________。
【答案】 ① Fe、Cr Fe2O3 、CaSiO3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 蒸发浓缩 冷却结晶 Cr2O72-+2OH- = 2CrO42-+H2O
【解析】(1)从流程前后物质变化分析,Cr2O3最后生成了红矾钠(Na2Cr2O7),步骤②③④均不涉及氧化还原反应,只有①中矿物在空气中锻烧发生氧化还原反应,FeO也在这步被氧化,故步骤①发生氧化还原反应,Fe、Cr元素被氧化;(2)高温条件下,C2O3、SiO2、Al2O3与Na2CO3、CaCO3生成硅酸盐、偏铝酸盐、铬酸盐等,氧化亚铁被氧化为氧化铁,经水浸后过滤,滤渣1的主要成分是Fe2O3 、CaSiO3;向滤液中通入CO2,生成氢氧化铝沉淀,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(注意流程中CO2是过量时,还生成碳酸氢根离子); (3)Na2CrO4在酸性环境下转变为Na2Cr2O7,将溶液蒸发浓缩、冷却结晶、过滤洗涤、烘干称量即可得到其晶体。(4)向橙红色的红钒钠溶液中滴入氢氧化钠溶液,变为黄色Na2CrO4溶液,写出该转化过程的离子方程式:Cr2O72-+2OH- = 2CrO42-+H2O。

 阅读快车系列答案
阅读快车系列答案