题目内容
9.下列各组中两种微粒所含电子数不相等的是( )| A. | H3O+ 和OH- | B. | CO和N2 | C. | HNO2和NO2- | D. | CH3+ 和NH4+ |
分析 质子数=各原子质子数的和,阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数.
解答 解:A.H3O+ 和OH-质子数分别为:11、9,电子数分别为10、10,故A错误;
B.CO和N2质子数分别为:14、14,电子数分别为14、14,故B错误;
C.HNO2和NO2-质子数分别为:21、20,电子数分别为21、21,故C错误;
D.CH3+ 和NH4+质子数分别为:9、11,电子数分别为8、10,故D正确.
故选D.
点评 本题考查分子和离子中质子数和电子数的计算,难度不大.要注意阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数.

练习册系列答案
相关题目
19. 的系统命名的名称是( )
的系统命名的名称是( )
 的系统命名的名称是( )
的系统命名的名称是( )| A. | 1,2-二溴-2-环己烯 | B. | 1,2-二溴-1-环己烯 | ||
| C. | 1,6-二溴-1-环己烯 | D. | 2,3-二溴-1-环己烯 |
20.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 氯化铵与苯分别受热变为气体 | B. | 氯化钠与氯化氢分别溶解在水中 | ||
| C. | 碘与干冰分别受热变为气体 | D. | NaHSO4受热熔化与溶于水变为溶液 |
17.如图是立方烷的球棍模型,下列有关说法正确的是( )
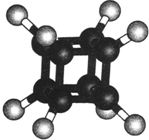

| A. | 它在核磁共振氢谱中只出现一个峰 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它不易燃烧 | |
| D. | 它与苯乙烯(C6H5-CH═CH2)不是同分异构体 |
4.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |
14.25℃时,向10mLpH=12的某碱溶液中加入10mLpH=2的盐酸,充分反应后滴入石蕊试液,溶液显蓝色,则此碱一定是( )
| A. | 弱碱 | B. | 一元强碱 | C. | 多元强碱 | D. | 任何强碱 |
1.金属镁是六方最密堆积,金属铜是面心立方最密堆积,如图分别给出它们的堆积状况和晶胞示意图,它们空间利用率相同,假定镁、铜原子均为刚性小球,已知球的半径分别为R1厘米、R2厘米,阿伏伽德罗常数NA
 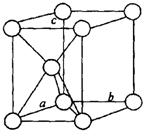 | (1)镁原子在二维空间的配位数为6 |
| (2)位于晶胞中部的鎂原子与离它最近两平面相切(填“相离”或“相切”或”相交”) | |
| (3)请用含R1、NA的数学式子表达金属镁的密度:$\frac{3\sqrt{2}}{{{R}_{1}}^{3}{N}_{A}}$g/cm3(根号带在分子上) | |
  | (4)铜原子在三维空间的配位数为12 |
| (5)晶胞中面心上的六个铜原子构成的空间几何体名称为正八面体 | |
| (6)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}{{•R}_{2}}^{3}}$g/cm3(根号带在分子上) |
19.下列物质沸点最低的是( )
| A. | 庚烷 | B. | 新戊烷 | C. | 正戊烷 | D. | 2-甲基丁烷 |