题目内容
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图(金属单质E可由滤液C制取):
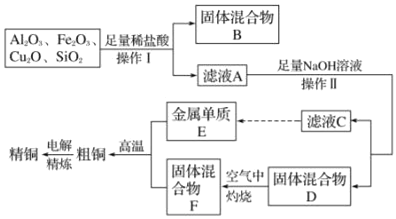
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物B的成分是_____。它与NaOH溶液反应的离子方程式为_____。
(2)滤液A中铁元素的存在形式为_____(填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____。要检验该铁元素的离子的实验_____
(3)在滤液C中通入足量CO2的离子方程式为_____
(4)金属单质E从固体混合物F中置换出Cu的化学方程式为_____
【答案】SiO2和Cu SiO2+2OH-=SiO32-+H2O Fe2+ Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+ 取少量溶液于试管中,滴加KSCN,溶液不变红,再加入氯水,溶液变为血红色,则有Fe2+ OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2Al+3CuO 高温 Al2O3+3Cu
【解析】
氧化亚铜与盐酸反应生成铜和铜离子,二氧化硅与盐酸不反应,氧化铁与盐酸反应生成Fe3+,铁离子与铜反应生成亚铁离子,固体为二氧化硅和铜,滤液中含有铜离子、亚铁离子、铝离子,加入足量的氢氧化钠溶液,滤液C中含有偏铝酸根离子,金属E为铝,固体D为氢氧化铜和氢氧化铁的混合物,在空气中灼烧,F为氧化铜和氧化铁的混合物,粗铜为铜、铝、铁的混合物,经过电解可得到纯铜。
(1)固体混合物B的成分是SiO2和Cu。它与NaOH溶液即二氧化硅与氢氧化钠反应,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
(2)氧化亚铜与盐酸反应生成铜单质和铜离子,氧化铁与盐酸反应生成铁离子,与铜反应生成亚铁离子,有铜剩余,故铁离子完全转化为亚铁离子,滤液A中铁元素的存在形式为Fe2+,生成该离子与Fe元素有关的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+。要检验该铁元素的离子的实验为取少量溶液于试管中,滴加KSCN,溶液不变红,再加入氯水,溶液变为血红色,则有Fe2+。
(3)在滤液C中含有偏铝酸钠和氢氧化钠,通入足量CO2的离子方程式为OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(4)金属单质E为铝,从固体混合物F为氧化铜和氧化铁的混合物,置换出Cu的化学方程式为铝热反应,2Al+3CuO高温Al2O3+3Cu。

【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
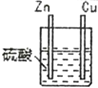
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
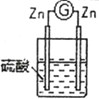
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
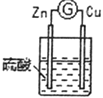
3 |
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。
【题目】以黄铜矿(主要成分为 CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
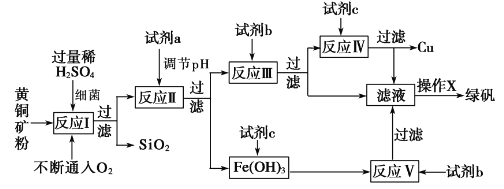
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列说法不正确的是
A. 试剂a可以是CuO或Cu(OH)2,作用是调节pH至3.7~4.7之间
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素被还原
C. 操作X为蒸发浓缩至溶液表面出现晶膜,再冷却结晶
D. 反应Ⅲ的离子方程式为Cu2++Fe==Cu+Fe2+,试剂c参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O