题目内容
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。

请回答下列问题:
(1)焰色反应是_____(填“物理”或“化学”)变化;实验③中产生的无色无味气体是_____(填化学式)。
(2)原溶液中一定存在的离子有_____,一定不存在的离子有_____(写化学式)。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=_____。
【答案】物理 O2 Na+、Mg2+、Al3+、SO42- Fe3+、Cu2+、CO32-、NH4+ 0.6mol/L
【解析】
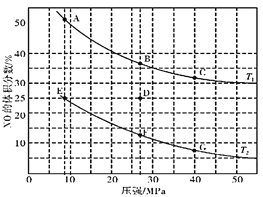
溶液焰色反应呈黄色,说明溶液中含有Na+离子,溶液呈无色,则一定不含有色离子:Fe3+、Cu2+,加入氯化钡和盐酸后生成白色沉淀,由于溶液中没有Ag+离子,则生成沉淀为BaSO4,溶液中含有SO42-离子,逐滴加入过量NaOH溶液有白色沉淀,则溶液中含有Mg2+离子,判断一定无CO32-,图象分析可知,实验中生成白色沉淀的量与加入NaOH的量的先增大后减小,则说明溶液中含有Al3+离子,加入过氧化钠产生的是无色无味的气体,可以判定一定没有NH4+,可以推断一定含有Mg2+、Na+、Al3+,由于Mg2+和CO32-不能共存,所以一定没有CO32-,不能判断溶液中是否含有K+,据此进行解答。
(1)焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,焰色反应是物理变化;实验③是过氧化钠和水反应生成氢氧化钠和氧气,则产生的无色无味气体是O2;
(2)根据以上分析,原溶液中一定存在的离子有Al3+、Na+、Mg2+、SO42-,一定不存在的离子有Fe3+、Cu2+、CO32-、NH4+;
(3)依据图形变化可知,Mg2+物质的量为0.1mol,Al3+物质的量为0.1mol,SO42-离子物质的量等于硫酸钡沉淀物质的量=![]() =0.3mol,溶液体积为100mL,若溶液中K+物质的量为0.04mol,依据电荷守恒计算c(K+)+c(Na+)+3c(Al3+)+2c(Mg2+)=2c(SO42-),c(Na+)=2×3mol/L-0.4mol/L-3×1mol/L-2×1mol/L=0.6mol/L。
=0.3mol,溶液体积为100mL,若溶液中K+物质的量为0.04mol,依据电荷守恒计算c(K+)+c(Na+)+3c(Al3+)+2c(Mg2+)=2c(SO42-),c(Na+)=2×3mol/L-0.4mol/L-3×1mol/L-2×1mol/L=0.6mol/L。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案