题目内容
【题目】H2Y2-是乙二胺四乙酸根(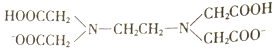 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0
FeY2-(NO)(aq) △H<0
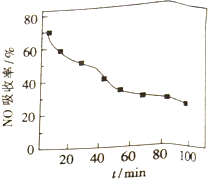
(1)将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________。
(2)生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K为平衡常数) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
①表中最不稳定的金属络合物是_____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为________(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________。
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,/span>废水处理效果越好,这是因为______________。

【答案】 反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低 0.1mol CaY2- Fe3+ 6 40-OH+H12C10N2O84-+4H+=10CO2↑+N2↑+28H2O 酸性越强,Na2FeO4越容易分解;pH越大,Cu2+更容易沉淀;Na2FeO4氧化Y4-,自身被还原成Fe3+,水解产生的Fe(OH)3胶体有絮凝作用,使Cu(OH)2更易沉降
【解析】I.(1)根据反应FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0可知,反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低,时间越长,NO吸收率越低;(2)根据反应FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3中铁化合价由0变为+2价,氮元素化合价由+2价变为了3价,最小公倍数为10,配平得反应2FeY2-(NO)(aq)+5Fe+8H2O=2FeY2-(aq)+5Fe(OH)2+2NH3,若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为
FeY2-(NO)(aq) △H<0可知,反应放热,温度升高,不利于NO的吸收;随着反应进行,FeY2-浓度降低,时间越长,NO吸收率越低;(2)根据反应FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3中铁化合价由0变为+2价,氮元素化合价由+2价变为了3价,最小公倍数为10,配平得反应2FeY2-(NO)(aq)+5Fe+8H2O=2FeY2-(aq)+5Fe(OH)2+2NH3,若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为![]() ;II. (1)根据表中数据可知,lgK越小,K越小,络全反应逆向移动,络合物越不稳定,则最不稳定的金属络合物是CaY2-;向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为Fe3+,根据lgK大小可知,加入Fe3+,平衡Fe3++H2Y2-
;II. (1)根据表中数据可知,lgK越小,K越小,络全反应逆向移动,络合物越不稳定,则最不稳定的金属络合物是CaY2-;向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为Fe3+,根据lgK大小可知,加入Fe3+,平衡Fe3++H2Y2-![]() FeY-+2H+正向移动,H2Y2-浓度降低,平衡Cu2++H2Y2-
FeY-+2H+正向移动,H2Y2-浓度降低,平衡Cu2++H2Y2-![]() CuY2-+2H+逆向移动,可解离出Cu2+;②常温下Ksp[Cu(OH)2]= c(Cu2+)c2(OH-) =2.2×10-20,若要使c(Cu2+)≤2.2×10-4mol/L,则c2(OH-)
CuY2-+2H+逆向移动,可解离出Cu2+;②常温下Ksp[Cu(OH)2]= c(Cu2+)c2(OH-) =2.2×10-20,若要使c(Cu2+)≤2.2×10-4mol/L,则c2(OH-)![]() ,c(OH-)
,c(OH-)![]() ,pH应不低于6;(2)①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。反应的离子方程式为40-OH+H12C10N2O84-+4H+=10CO2↑+N2↑+28H2O;②根据图中曲线变化可知。pH越大,废水处理效果越好,这是因为酸性越强,Na2FeO4越容易分解;pH越大,Cu2+更容易沉淀;Na2FeO4氧化Y4-,自身被还原成Fe3+,水解产生的Fe(OH)3胶体有絮凝作用,使Cu(OH)2更易沉降。
,pH应不低于6;(2)①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。反应的离子方程式为40-OH+H12C10N2O84-+4H+=10CO2↑+N2↑+28H2O;②根据图中曲线变化可知。pH越大,废水处理效果越好,这是因为酸性越强,Na2FeO4越容易分解;pH越大,Cu2+更容易沉淀;Na2FeO4氧化Y4-,自身被还原成Fe3+,水解产生的Fe(OH)3胶体有絮凝作用,使Cu(OH)2更易沉降。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案【题目】实验室用密度为1.18 g·mL-1,质量分数为36.5%浓盐酸配制250 mL 0.1 mol·L-1 的盐酸,填空并回答下列问题:
(1)配制250 mL 0.1 mol·L-1的盐酸___________。
应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 容量瓶外还需的其他仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________。
A.用30 mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是___________,溶液注入容量瓶前需恢复到室温,这是因为___________;
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线___________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面___________。