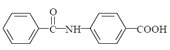
��Ŀ����
����Ŀ��ʵ�������ܶ�Ϊ1.18 g��mL-1����������Ϊ36.5%Ũ��������250 mL 0.1 mol��L-1 �����ᣬ��ղ��ش��������⣺
��1������250 mL 0.1 mol��L-1������___________��
Ӧ�����������/mL | Ӧѡ������ƿ�Ĺ��/mL | ����ƿ������������ |
��2������ʱ������ȷ�IJ���˳����(��ĸ��ʾ��ÿ����ĸֻ����һ��)___________��
A.��30 mLˮϴ���ձ��Ͳ�����2��3�Σ�ϴ��Һ��ע������ƿ����
B.����Ͳȷ��ȡ�����Ũ�����������ز����������ձ��У��ټ�������ˮ(Լ30 mL)���ò���������������ʹ���Ͼ���
C.������ȴ�������ز�����ע��250 mL������ƿ��
D.������ƿ�ǽ�����ҡ��
E.���ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�������
F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���1��2 cm��
��3������A�У���ϴ��Һ����������ƿ����Ŀ����___________����Һע������ƿǰ��ָ������£�������Ϊ___________��
��4����ʵ������г������������δ�����������ˮʱ���������˿̶���___________��������ƿ��ת����Һʱ(ʵ�鲽���)������Һ�ε�������ƿ����___________��
���𰸡� 2.1��250����Ͳ���ձ�������������ͷ�ι� B��C��A��F��E��D ��֤����ȫ��ת������ƿ ����ƿʢ������Һʱ�������,Ҳ��������ƿը�� ����ʵ��ʧ�ܣ�ϴ������ƿ���������� ����ʵ��ʧ�ܣ�ϴ������ƿ����������
��������
��1������![]() ��֪Ũ��������ʵ���Ũ��Ϊ1000��1.18��36.5%/36.5 mol/L��11.8 mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ�������ã�V��11.8mol/L=0.1mol/L��250mL�����V=2.1 mL������ʱ������Ҫ250mL����ƿ���⣬����Ҫ��Ͳ���ձ�������������ͷ�ιܣ�
��֪Ũ��������ʵ���Ũ��Ϊ1000��1.18��36.5%/36.5 mol/L��11.8 mol/L������ҪŨ�������ΪV����������Һϡ���������ʵ����ʵ�������ã�V��11.8mol/L=0.1mol/L��250mL�����V=2.1 mL������ʱ������Ҫ250mL����ƿ���⣬����Ҫ��Ͳ���ձ�������������ͷ�ιܣ�
��2������һ�����ʵ���Ũ�ȵ���Һ���裺���㡢�������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȵȣ�����ȷ��˳��Ϊ��BCAFED��
��3������A�У���ϴ��Һ����������ƿ����Ŀ���DZ�֤����ȫ��ת������ƿ����������ƿʢ������Һʱ���������Ҳ��������ƿը�ѣ������Һע������ƿǰ��ָ������£�
��4��������ˮʱ���������˿̶��ߣ���Һ������ӣ���Һ��Ũ��ƫС����Ҫϴ������ƿ���������ƣ�������ƿ��ת����Һʱ(ʵ�鲽���)������Һ�ε�������ƿ���棬���ʼ��٣���Һ��Ũ��ƫС����Ҫϴ������ƿ���������ơ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��


��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����
����Ŀ��H2Y2-���Ҷ����������(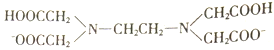 )�ļ�д��������ֽ��������γ�����
)�ļ�д��������ֽ��������γ�����
I. H2Y2-��Fe2+�γɵ������FeY2-���������������е�NO��������ԭ��:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) ��H<0
FeY2-(NO)(aq) ��H<0
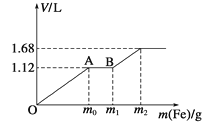
��1������NO��������һ��������ͨ����ʼ�¶�Ϊ50����FeY2-��Һ�С�NO��������ͨ��������ʱ��仯����ͼ��ʱ��Խ����NO������Խ�͵�ԭ����_________��
��2�����ɵ�FeY2-(NO)(aq)��ͨ���������ۻ�ԭ��������ԭ��:FeY2-(NO)(aq)+Fe+H2O��FeY2-(aq)+Fe(OH)2+NH3(δ��ƽ)��
������Һ��������14g���ۣ��������յ������к���NO�����ʵ���Ϊ_______��
II.���ͭ(CuY2-)��ˮ�Ĵ���һֱ�ǻ�������������о��ȵ㡣
��1��H2Y2-��Cu2+��Fe3+��Ca2+���������±�:
��Ϸ�Ӧ | lgK(KΪƽ�ⳣ��) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
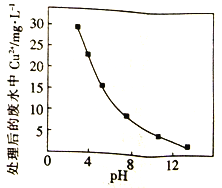
��������ȶ��Ľ����������_____(�ѧʽ)���������ͭ(CuY2-)��ˮ�м���һ�ֻ�ɫ������ҺA�ɽ����Cu2+������A��������Ϊ________(�ѧʽ)��
������pH�ɽ��������Cu2+ת��ΪCu(OH)2��������Ҫʹc(Cu2+)��2.2��10-4mol/L��pHӦ������________(������Ksp[Cu(OH)2]= 2.2��10-20)��
��2���ǻ����ɻ�(-OH)��Na2FeO2�����������ͭ�е�Y4-��ʹCu2+�õ����롣
��������������-OH�ɽ�Y4-(C10H12O8N24-)��������CO2��H2O��N2���÷�Ӧ�����ӷ���ʽΪ___________________��
��Na2FeO4�����������²��ȶ�����Na2FeO4������ķ�ˮ��Cu2+��Ũ����pH�Ĺ�ϵ����ͼ��pHԽ����/span>��ˮ����Ч��Խ�ã�������Ϊ______________��