题目内容
【题目】化合物E是一种合成高血压药物的中间体,其合成路线流程图如下:

(1)  中所含官能团名称为_____和______。
中所含官能团名称为_____和______。
(2)苯环上的硝基对新引入基团的位置会产生一定的影响,如:
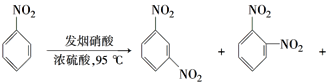 (产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为_________。
(产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为_________。
(3)写出同时满足下列条件的B的一种同分异构体X的结构简式: _________。
①含有两个苯环,分子中有6种不同化学环境的氢;
②既能与盐酸反应,又能与NaHCO3溶液反应。
(4)合成E时,还可能生成一种与E互为同分异构体的副产物Y,Y的结构简式为______。
(5)常温下,苯酚在Br2的CCl4溶液中发生取代反应,得到一溴代物。请写出以苯酚、CCl4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
【答案】 碘原子 醚键 FeBr3 ![]()


【解析】(1)  中所含官能团名称为碘原子和醚键;(2)苯环上的硝基对新引入基团的位置会产生一定的影响,根据流程可知,若在硝基苯上引入新基团则应该主要取代在硝基的间位上,故制备A时应该选制得溴苯,则反应条件为加入FeBr3作催化剂;(3)B(
中所含官能团名称为碘原子和醚键;(2)苯环上的硝基对新引入基团的位置会产生一定的影响,根据流程可知,若在硝基苯上引入新基团则应该主要取代在硝基的间位上,故制备A时应该选制得溴苯,则反应条件为加入FeBr3作催化剂;(3)B( )的同分异构体X,①含有两个苯环,分子中有6种不同化学环境的氢,对称性较强;②既能与盐酸反应,又能与NaHCO3溶液反应,故应该含有氨基和羧基,符合条件的有
)的同分异构体X,①含有两个苯环,分子中有6种不同化学环境的氢,对称性较强;②既能与盐酸反应,又能与NaHCO3溶液反应,故应该含有氨基和羧基,符合条件的有![]() ;(4)合成E时,根据流程中可知生成E时环氧开链开在右边生成E,若开链开在左则可能生成一种与E互为同分异构体的副产物Y,Y的结构简式为
;(4)合成E时,根据流程中可知生成E时环氧开链开在右边生成E,若开链开在左则可能生成一种与E互为同分异构体的副产物Y,Y的结构简式为 ;(5)常温下,苯酚在Br2的CCl4溶液中发生取代反应,得到一溴代物。结合流程信息,苯酚与溴的四氯化碳反应生成对溴苯酚,对溴苯酚在铜的催化下生成
;(5)常温下,苯酚在Br2的CCl4溶液中发生取代反应,得到一溴代物。结合流程信息,苯酚与溴的四氯化碳反应生成对溴苯酚,对溴苯酚在铜的催化下生成![]() ;苯酚与氢气发生加成反应生成
;苯酚与氢气发生加成反应生成![]() ,
,![]() 与浓的氢溴酸发生取代反应生成
与浓的氢溴酸发生取代反应生成![]() ,
,![]() 与
与![]() 在氢氧化钠中反应生成
在氢氧化钠中反应生成 ;合成路线流程如下:
;合成路线流程如下: 。
。

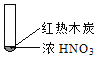
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
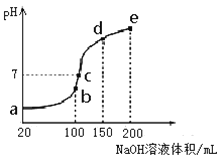
【题目】某小组利用如图装置,用苯与溴在FeBr3催化作用下制备溴苯:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解性 | 微溶 | 微溶 | 微溶 |
实验过程:在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴。向a中滴入几滴溴。反应剧烈进行。反应停止后按如下流程分离提纯产品:

(1)烧瓶中有大量红棕色蒸气,试管d中的现象是:①______________;② 蒸馏水逐渐变成黄色。c的作用是___________________________________。
(2)分离提纯时,操作Ⅰ为______________,操作Ⅱ为_________________。
(3)“水洗”需要用到的玻璃仪器是_________、烧杯,向“水洗”后所得水相中滴加KSCN溶液,溶液变红色。推测水洗的主要目的是除去__________________。
(4)“NaOH溶液洗”时反应的化学方程式是________________________。
(5)已知苯与溴发生的是取代反应,推测反应后试管d中液体含有的两种大量离子是H+和Br-,设计实验方案验证推测。(限选试剂:Mg、CCl4、AgNO3aq、H2O)
实验步骤 | 预期现象 | 结论 |
步骤1:将试管d中液体转入分液漏斗, __________________________________,将所取溶液等分成两份,置于A、B两试管中,进行步骤2、3。 | ||
步骤2: 。 | 证明有 存在 | |
步骤3: 。 | 证明有 存在 |
【题目】H2Y2-是乙二胺四乙酸根(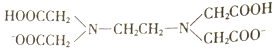 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0
FeY2-(NO)(aq) △H<0
(1)将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________。
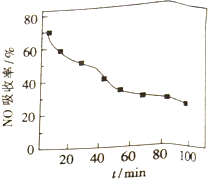
(2)生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K为平衡常数) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
①表中最不稳定的金属络合物是_____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为________(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________。
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,/span>废水处理效果越好,这是因为______________。