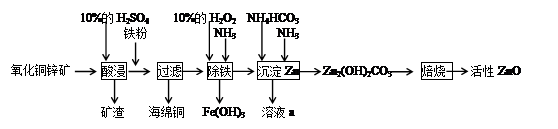题目内容
下列各实验装置图的叙述中,正确的是( )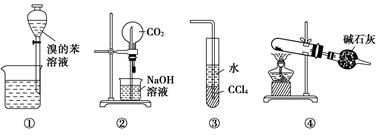
| A.装置①为放出萃取溴水后的苯层 |
| B.装置②为喷泉实验 |
| C.装置③可用来吸收HCl气体 |
| D.以NH4Cl为原料,装置④可用于制备少量NH3 |
B
解析

 阅读快车系列答案
阅读快车系列答案亚铁盐中,FeSO4?7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4?FeSO4?6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O。
实验室用废铁屑制备莫尔盐的过程如下: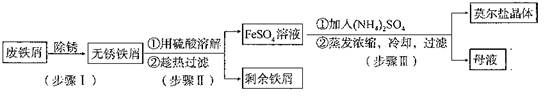
(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象和结论 |
| 步骤1 | 取少量样品 | 样品颜色可能有变化。 |
| 步骤2 | 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 | 若 ,说明样品中含有FeSO4·7H2O杂质。 |
| 步骤3 | 若步骤2证明样品不含FeSO4?7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 | 若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
用下图所示装置进行实验,不能达到实验目的的是:( )
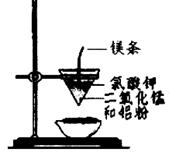
甲 乙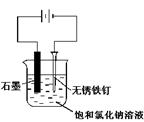
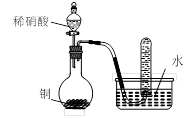
丙 丁
| A.用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B.用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C.用丙装置可实现对铁钉的保护 |
| D.用丁装置验证铜与稀硝酸反应的气体产物只有NO |
下列各组中的实验步骤及现象,能达到相应实验目的的是
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 | 试样  白色沉淀 白色沉淀 沉淀不溶解 沉淀不溶解 |
| B | 制取氯气并探究氯气是否具有漂白性 | MnO2和稀盐酸 气体 气体 褪色 褪色 |
| C | 证明酸性条件H2O2氧化性比I2强 | 碘化钠溶液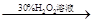 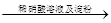 溶液变蓝色 溶液变蓝色 |
| D | 探究浓度对于化学平衡的影响 | FeCl3和KSCN混合溶液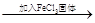 红色变深 红色变深 |
下列不能达到实验目的的是
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
| B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
如图带漏斗U型管中装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和水的界面a附近上下往复运动,下列说法不正确的是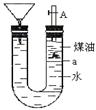
| A.此碱金属可能是钾或钠 |
| B.反应一段时间煤油会燃烧 |
| C.碱金属上下运动是由于与水反应产生了氢气 |
| D.若是金属锂则不能观察到上述现象 |
下述实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积的盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是
( )。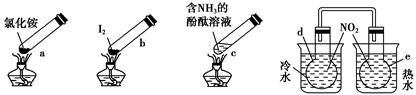
| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.e内气体颜色变浅,d内气体颜色加深 |