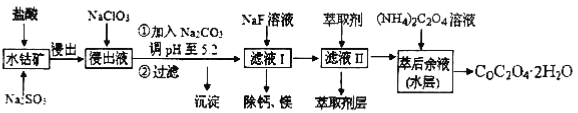
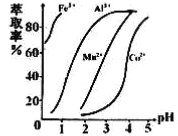
题目内容
【题目】纳米ZnO在催化、医药及橡胶等新材料方面有广阔的应用前景,下面是制备纳米ZnO的相关工艺流程,试回答有关问题:
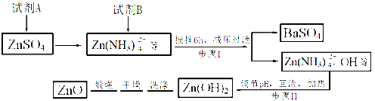
已知:Ksp[Zn(OH)2]=4.5×10-17,且Zn(OH)2具有两性。
(1) 试剂A是_____,试剂B是______,步骤I生成BaSO4的离子方程式是 。
(2)步骤II中,pH应调节至 (填序号)。
a.3~5 b.5 c.8~9 d.12~14
(3)步骤II中“回流”时必须用到下列仪器中的 (填序号)。
a.分液漏斗 b.温度计 c.空气冷凝管 d.球形冷凝管
(4)已知,在实验室中用200 mL 0.25 mol/L ZnSO4溶液与50 mL 8mol/L的试剂A反应,则加入固体试剂B的质量为 (计算结果保留小数点后一位)。
(5)步骤II在加热回流的同时,要蒸出 (填物质名称),该物质可循环使用。
(6)纳米ZnO也可以用以下流程制备(其中反应②生成了两种碳的化合物)。
![]() 书写相关的化学方程式① ,② 。
书写相关的化学方程式① ,② 。
【答案】(1)氨水,Ba(OH)2 ,Ba2++SO42-=BaSO4↓;
(2)c ,
(3)d ;
(4)8.6g ;
(5)氨气;
(6)H2C2O4+ZnCl2+2H2O=ZnC2O4·2H2O+2HCl ,ZnC2O4·2H2O=ZnO+CO↑+CO2↑+2H2O 。
【解析】
试题分析:(1)根据流程图,加试剂A后的产物,试剂A应是NH3或氨水,加入试剂B后,得到BaSO4,说明所加试剂B含Ba2+,不引入新的杂质,因此试剂B为Ba(OH)2,反应离子方程式为Ba2++SO42-=BaSO4↓;
(2)离子浓度小于等于1×10-5,说明沉淀完全,c2(OH-)=Ksp/c(Zn2+)=4.5×10-12,利用水的离子积,以及pH的计算公式,大概在8左右,故选项c正确;
(3)“回流”用冷凝管较好,球形冷凝管冷凝效果好,故选项d正确;
(4)根据SO42-守恒,n[Ba(OH)2]=n(ZnSO4)=200×10-3×0.25mol=0.05mol,m[Ba(OH)2]=0.05×171g=8.55g;(5)根据流程图以及元素守恒,加热蒸馏蒸出的氨气;
(6)①根据具流程制备,其反应方程式为ZnCl2+H2C2O4+2H2O=ZnC2O4·H2O+2HCl;②生成两种碳的化合物,应是CO、CO2,因此反应方程式为:ZnC2O4·2H2O=ZnO+CO↑+CO2↑+2H2O 。

【题目】(14 分)对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应、装置图如下:
![]()
![]()
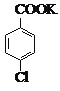 +MnO2
+MnO2 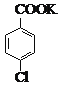
![]()
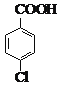
常温条件下的有关数据如下表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
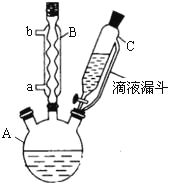
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
请回答下列问题:
(1)装置B的名称是 。
(2)量取6.00mL对氯甲苯应选用的仪器是 。(填选仪器序号)
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 。对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 。
(4)第一次过滤的目的是 ,滤液中加入稀硫酸酸化,可观察到的实验现象是 。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 。
(6)本实验的产率是 (填标号)。A.60% B.70% C.80% D.90%
【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据
化学键 | P—P | P—O | O=O | P=O |
键能 kJ·mol-1 | 197 | 360 | 499 | X |
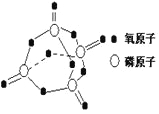
己知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0kJ ,且白磷分子结构为正四面体,4 个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如上图所示,则上表中X为
A.434 B.335 C.237 D.188
【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。