题目内容
17.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
| A. | 碳的燃烧热为110.5kJ.mo1-1 | |
| B. | 反应①的反应热为221 kJ.mo1-1 | |
| C. | 98%的浓硫酸与稀氢氧化钠溶液反应生成1 mo1水时放出热量大于57.3 kJ | |
| D. | 稀醋酸与稀氢氧化钠溶液反应生成l mo1水时放出57.3 kJ的热量 |
分析 A、CO燃烧生成二氧化碳继续放出热量;
B、反应热包含符号,①的反应热为-221 kJ•mol-1;
C、浓硫酸稀释还要放出热量;
D、醋酸是弱电解质,电离需吸收热量.
解答 解:A、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,故A错误;
B、反应热包含符号,①的反应热为-221 kJ•mol-1,故B错误;
C、浓硫酸稀释放出热量,所以放出的热量大于57.3 kJ,所以98%的浓硫酸与稀氢氧化钠溶液反应生成1 mo1水时放出热量大于57.3 kJ/mol,故C正确;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D错误;
故选C.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
7.下列有关化学用语正确的是( )
| A. | 氯化氢分子的电子式: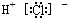 | |
| B. | H2O的结构式:H-O-H | |
| C. | 硫原子的结构示意图: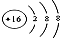 | |
| D. | 原子核内有8个中子的氧原子:${\;}_{8}^{18}$O |
8.下列说法或计算正确的是( )
| A. | 采用加热蒸发溶剂的方法可以使浓度为4 mol/L的盐酸溶液的浓度变为8 mol/L | |
| B. | 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% | |
| C. | 将2.3 g Na投入到97.7g水中充分反应,所得溶液的质量分数为4.0% | |
| D. | 已知某温度下KNO3的溶解度是31.6 g,该温度下将20 g KNO3溶解于50 g水中,充分溶解,获得溶液的质量分数是28.6% |
12.下列说法正确的是( )
| A. | π键是由两个p轨道“头碰头”重叠形成的 | |
| B. | σ键一定是有s轨道参与形成的 | |
| C. | 甲烷分子中的键全为σ键而乙烯分子中含σ键和π键 | |
| D. | H2分子中含σ键而Cl2分子中还含π键 |
2.下列说法正确的是( )
| A. | 二氧化硫具有还原性 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
9.按常温常压下沸点升高的次序,排列正确的是:( )
①正丁烷 ②壬烷 ③异丁烷 ④三十烷.
①正丁烷 ②壬烷 ③异丁烷 ④三十烷.
| A. | ②③①④ | B. | ③①②④ | C. | ①③②④ | D. | 无法确定 |
6.元素X的原子获得3个电子或Y的原子失去了2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下反应产物的化学式为( )
| A. | Y3X2 | B. | X2Y3 | C. | X3Y3 | D. | Y2X3 |
7.电子数相等的粒子叫做等电子体,下列各组粒子属于等电子体是( )
| A. | NO和NO2 | B. | CO和CO2 | C. | CO2和SO2 | D. | CH4和NH3 |
 .
.