题目内容
9.碳酸二甲酯(简称DMC)是一个绿色化学品,可取代光气等有毒物质作为羰基化或甲基化试剂,如:
合成DMC的一种方法如下:

(1)DMC的分子式为C3H6O3,1mol DMC在氧气中完全燃烧消耗3molO2.
(2)化合物II核磁共振氢谱有4组峰;1mol该物质与NaOH溶液在加热条件下反应最多消耗3molNaOH.
(3)反应①中副产物甲醇发生催化氧化反应的方程式为
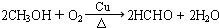 .
.(4)反应②原子利用率100%,则化合物Ⅲ是二氧化碳或CO2.
分析 (1)根据结构简式确定分子式,该物质的分子式可以改写为C3(H2O)3,1mol该物质消耗氧气的物质的量等于C消耗的氧气量;
(2)该物质中氢原子种类有4种,有几种氢原子其核磁共振氢谱就有几种吸收峰;该物质水解生成的羧基、酚羟基和NaOH反应;
(3)在催化剂、加热条件下,甲醇被催化氧化生成甲醛;
(4)反应②原子利用率100%,说明该反应是加成反应,则化合物Ⅲ为二氧化碳或CO2.
解答 解:(1)根据结构式知,该物质分子式为C3H6O3,该物质的分子式可以改写为C3(H2O)3,1mol该物质消耗氧气的物质的量等于C消耗的氧气量,所以消耗3mol氧气,
故答案为:C3H6O3;3;
(2)该物质中氢原子种类有4种,有几种氢原子其核磁共振氢谱就有几种吸收峰,所以有4组峰;该物质水解生成的羧基、酚羟基和NaOH反应,所以1mol该物质与NaOH溶液在加热条件下反应最多消耗3molNaOH,故答案为:4;3;
(2)在催化剂、加热条件下,甲醇被催化氧化生成甲醛,反应方程式为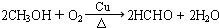 ,故答案为:
,故答案为: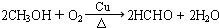 ;
;
(4)反应②原子利用率100%,说明该反应是加成反应,则化合物Ⅲ为二氧化碳或CO2,
故答案为:二氧化碳或CO2.
点评 本题考查有机物推断,为高频考点,明确反应前后物质结构变化与反应类型关系是解本题关键,难点是(1)中耗氧量的计算,易错点是(2)中II水解生成碳酸和苯酚,题目难度中等.

练习册系列答案
相关题目
11.下列物质能跟镁反应并生成氢气的是( )
| A. | 常温下在蒸馏水中 | B. | 氢氧化钠溶液 | ||
| C. | 氯化铵溶液 | D. | 碳酸钠溶液 |
12.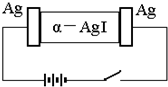 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )| A. | 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀 | |
| B. | 若α-AgI是Ag+导电则通电一段时间后晶体密度可能均匀 | |
| C. | 若α-AgI是I-导电则通电一段时间后晶体密度不均匀 | |
| D. | 若α-AgI是I-导电则通电一段时间后晶体密度仍均匀 |
4.某化学反应2A (g)≒B(g)+D(g) 在4种不同条件下进行,B和D的起始浓度为0,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如表:
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.013mol•L-1•min-1,反应经40min就达到平衡.
(2)实验2中,A的初始浓度c2=1.0mol•L-1,反应经20min就达到平衡.
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是反应达到平衡所需时间短.
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.013mol•L-1•min-1,反应经40min就达到平衡.
(2)实验2中,A的初始浓度c2=1.0mol•L-1,反应经20min就达到平衡.
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是反应达到平衡所需时间短.
19.下列排列顺序不正确的是( )
| A. | 原子半径:Na>S>O | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 元素金属性:Na>Mg>Al |
 .
.
 (1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:
(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下: