题目内容
6.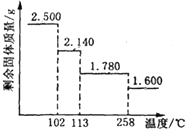 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图.以下说法正确的是 ( )| A. | 晶体从常温升至105℃的过程中只有氢键断裂 | |
| B. | 受热过程中,胆矾晶体中形成配位键的4个水分子同时失去 | |
| C. | 120℃时,剩余固体的化学式是CuSO4•H2O | |
| D. | 按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子所处化学环境可以分为3种 |
分析 A、由信息可知,胆矾晶体另一个水分子只以氢键与相邻微粒结合,所以只有氢键断裂,说明失去一个结晶水;
B、由图可知明显不是同时失去;
C、120℃时,剩下固体是1.78g,而失去4个水之后分子量就是178;
D、因为固体质量就是分三次降低的,而三次温度变化值不同,所以克服的作用力大小不同.
解答 解:A、由信息可知,胆矾晶体另一个水分子只以氢键与相邻微粒结合,所以只有氢键断裂,说明失去一个结晶水,而胆矾(CuSO4•5H2O)的分子量为250,如果失去1个水,则剩下232,所以2.5g的胆矾如果只有氢键断裂,剩下的质量为2.32g,而升至105℃时固体质量是2.14g,所以不只有氢键断裂,还有配位键断裂,故A错误;
B、由图可知明显不是同时失去,而是分三阶段失水,故B错误;
C、120℃时,剩下固体是1.78g,而失去4个水之后分子量就是178,所以剩余固体的化学式是CuSO4•H2O,故C正确;
D、因为固体质量就是分三次降低的,所以晶体中的水分子所处化学环境可以分为3种,故D正确;
故选CD.
点评 本题考查硫酸铜晶体中水分子所处化学环境结合图象分析考查,学生要有一定的分析推理能力,特别要要清楚随温度的改变固体质量三次降度这是解题的关键所在,有一定的难度.

练习册系列答案
相关题目
16.下列有机物的命名正确的是( )
| A. | 1,2─二甲基戊烷 | B. | 3─乙基戊烷 | C. | 3,4─二甲基戊烷 | D. | 2─甲基己烷 |
17.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法不正确的是( )
| A. | 该反应是焓变为正值 | |
| B. | 恒温恒容下,充入更多的CO2,能提高H2的转化率 | |
| C. | 升高温度,正、逆反应速率均增大 | |
| D. | 该反应化学方程式为:CO+H2O$?_{△}^{催化剂}$ CO2+H2 |
14.下些列有关电池的说法错误的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铅酸蓄电池中,铅电极是负极 | |
| C. | 甲醇醇燃料电池可把化学能转化为电能 | |
| D. | 铜锌原电池工作时,Zn2+沿外电路从正极流向负极 |
1.可逆反应 mA(g)+nB(g)?pC(g),在不同温度T、压强p下,生成物C的物质的量分数x(C)的变化情况,如图所示.下列对该反应的判断正确的是( )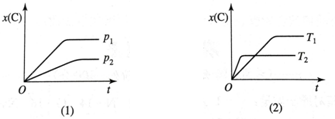

| A. | 吸热反应,m+n<p | B. | 吸热反应,m+n>p | C. | 放热反应,m+n<p | D. | 放热反应,m+n>p |
11.下列物质能跟镁反应并生成氢气的是( )
| A. | 常温下在蒸馏水中 | B. | 氢氧化钠溶液 | ||
| C. | 氯化铵溶液 | D. | 碳酸钠溶液 |
18.下列说法正确的是( )
| A. | 增大压强,活化分子数增多,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数不一定增大,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
15.下列过程的离子方程式正确的是( )
| A. | 氨水与醋酸的反应:NH3•H2O+CH3COOH=CH3COO-+NH4 ++H2O | |
| B. | 大理石与盐酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | H2SO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+OH-+Ba2+=BaSO4↓+H2O | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
4.某化学反应2A (g)≒B(g)+D(g) 在4种不同条件下进行,B和D的起始浓度为0,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如表:
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.013mol•L-1•min-1,反应经40min就达到平衡.
(2)实验2中,A的初始浓度c2=1.0mol•L-1,反应经20min就达到平衡.
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是反应达到平衡所需时间短.
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.013mol•L-1•min-1,反应经40min就达到平衡.
(2)实验2中,A的初始浓度c2=1.0mol•L-1,反应经20min就达到平衡.
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是反应达到平衡所需时间短.