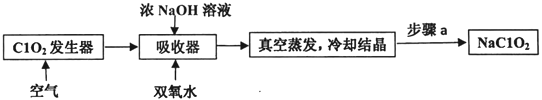
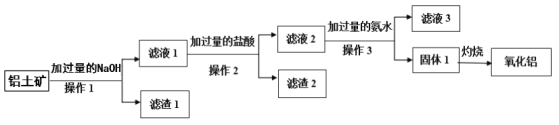
题目内容
【题目】毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C ![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 ![]() CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且未成对电子数最多的基态原子的电子排布式:___________;CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O,由此可以推知CN22-的空间构型为________。
(2)1mol尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为_______;
(3)三聚氰胺俗称“蛋白精”,其结构为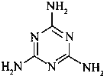 。其中氮原子的杂化方式有_____________。
。其中氮原子的杂化方式有_____________。
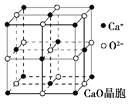
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______,Ca2+采取的堆积方式为____________,其中O2-处于Ca2+堆积形成的八面体空隙中;已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离_____________(列出计算式);
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=_____。
【答案】1s22s22p63s23p63d54s1或[Ar]3d54s1 直线形 1:7 sp2、sp3 6 面心立方最密堆积 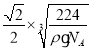 6
6
【解析】
(1)Ca位于第四周期,在第四周期,未成对电子数最多的基态原子的3d和4s能级应该都是半充满;根据价层电子对个数=σ键个数+孤电子对个数计算判断CN22-的空间构型;
(2)CO(NH2)2中C原子与氧原子之间形成C=O双键,C原子与N原子之间形成2个C-N单键,N原子与H原子之间共形成4个N-H键;
(3)分子的环中N原子形成2个σ键,含有1对孤电子对,杂化轨道数目为3,氨基中N原子形成3个σ键,含有1对孤电子对,杂化轨道数目为4;
(4)根据CaO晶胞的结构可知,以顶点上的钙离子为例,每个钙离子周围距离最近的氧离子位于晶胞棱边的中点;钙离子分布在晶胞的顶点和面心上;CaO2晶胞中距离最近的两个钙离子间的距离为面对角线的一半,根据晶胞的密度及晶胞中所含离子数目可求得晶胞的体积,进而求得晶胞的边长,再求得两个钙离子之间的距离;
(5)在配位化合物K3[Fe(CN)n]中每个配体可以提供一对电子,而铁原子最外层有2个电子,据此计算。
(1)与Ca在同一周期且未成对电子数最多的基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1;CN22-离子价层电子对个数=2+![]() ×(4+2-2×3)=2,且不含孤电子对,根据价层电子对互斥理论知空间构型为直线形;故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;直线形;
×(4+2-2×3)=2,且不含孤电子对,根据价层电子对互斥理论知空间构型为直线形;故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;直线形;
(2)CO(NH2)2中C原子与氧原子之间形成C=O双键,C原子与N原子之间形成2个C-N单键,N原子与H原子之间共形成4个N-H键,1mol 尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为1:7,故答案为:1:7;
(3)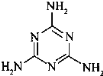 的环中N原子形成2个σ键,含有1对孤电子对,杂化轨道数目为3,采取sp2杂化,氨基中N原子形成3个σ键,含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,故答案为:sp2、sp3;
的环中N原子形成2个σ键,含有1对孤电子对,杂化轨道数目为3,采取sp2杂化,氨基中N原子形成3个σ键,含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,故答案为:sp2、sp3;
(4)根据CaO晶胞的结构可知,以顶点上的钙离子为例,每个钙离子周围距离最近的氧离子位于晶胞棱边的中点,这样的离子有6个;钙离子分布在晶胞的顶点和面心上,所以钙离子的堆积方式为面心立方最密堆积;在CaO晶胞中钙离子数为8×![]() +6×
+6×![]() =4,氧离子数为12×
=4,氧离子数为12×![]() +1=4,所以晶胞的体积为
+1=4,所以晶胞的体积为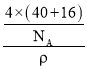 cm3,晶胞的边长为
cm3,晶胞的边长为![]() cm,所以距离最近的两个钙离子间的距离为面对角线的一半即为
cm,所以距离最近的两个钙离子间的距离为面对角线的一半即为![]() ×
×![]() cm,故答案为:6;面心立方最密堆积;
cm,故答案为:6;面心立方最密堆积;![]() ×
×![]() ;
;
(5)在配位化合物K[Fe(CN)n]中每个配体可以提供一对电子,而铁原子最外层有2个电子,根据铁原子的最外层电子数和配体提供电子数之和为14,可得2+2n=14,所以n=6,故答案为:6。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
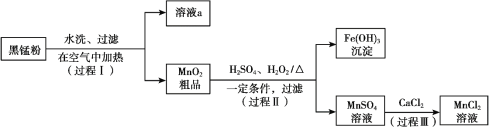
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
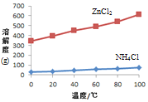
① 溶液a呈酸性,原因是______。
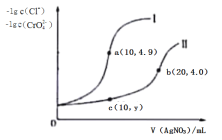
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
【题目】利用某冶金行业产生的废渣(主要含![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)可以制备
等杂质)可以制备![]() ,生产流程如下:
,生产流程如下:
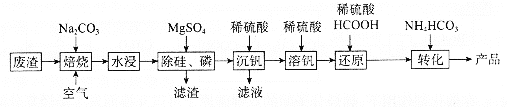
已知:![]() 微溶于水、溶于碱生成
微溶于水、溶于碱生成![]() (加热生成
(加热生成![]() ),具有强氧化性。向
),具有强氧化性。向![]() 溶液中加酸,不同
溶液中加酸,不同![]() 对应的主要存在形式如表:
对应的主要存在形式如表:
|
| 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
存在形式 |
|
|
|
|
|
|
回答下列问题:
(1)“焙烧”后V元素转化为![]() ,
,![]() 元素转化为________(写化学式)。
元素转化为________(写化学式)。
(2)欲除尽磷元素(即![]() ),最终溶液中
),最终溶液中![]() 的浓度至少为________
的浓度至少为________![]() (已知
(已知![]() )。
)。
(3)“沉钒”过程中,![]() 由8.5到5.0发生反应的离子方程式为________;最终需要控制
由8.5到5.0发生反应的离子方程式为________;最终需要控制![]() 约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
(4)“还原”和“转化”过程中主要反应的离子方程式分为________、________。