题目内容
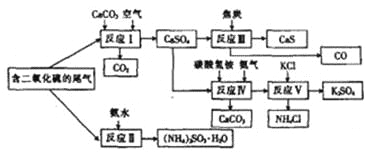
【题目】利用某冶金行业产生的废渣(主要含![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)可以制备
等杂质)可以制备![]() ,生产流程如下:
,生产流程如下:
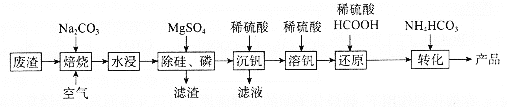
已知:![]() 微溶于水、溶于碱生成
微溶于水、溶于碱生成![]() (加热生成
(加热生成![]() ),具有强氧化性。向
),具有强氧化性。向![]() 溶液中加酸,不同
溶液中加酸,不同![]() 对应的主要存在形式如表:
对应的主要存在形式如表:
|
| 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
存在形式 |
|
|
|
|
|
|
回答下列问题:
(1)“焙烧”后V元素转化为![]() ,
,![]() 元素转化为________(写化学式)。
元素转化为________(写化学式)。
(2)欲除尽磷元素(即![]() ),最终溶液中
),最终溶液中![]() 的浓度至少为________
的浓度至少为________![]() (已知
(已知![]() )。
)。
(3)“沉钒”过程中,![]() 由8.5到5.0发生反应的离子方程式为________;最终需要控制
由8.5到5.0发生反应的离子方程式为________;最终需要控制![]() 约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
(4)“还原”和“转化”过程中主要反应的离子方程式分为________、________。
【答案】![]()
![]()
![]() 2
2 ![]()
![]()
![]()
【解析】
结合题干信息,根据(NH4)5(VO)6(CO3)4(OH)9·10H2O的生产流程分析,废渣加入Na2CO3在空气中焙烧得到NaVO3和Na2SiO3,Na3PO4,水浸后加入MgSO4得到H2SiO3和Mg3(PO4)2的滤渣除去,滤液加入稀硫酸沉钒最终得到V2O5,过滤,再加入稀硫酸溶解得到VO2+,加入HCOOH还原得到VO2+,加入NH4HCO3转化得到产品,据此分析解答。
(1)由上述分析可知,废渣加入Na2CO3在空气中焙烧得到NaVO3和Na2SiO3,Na3PO4,故答案为:Na2SiO3;
(2)因为Ksp[Mg3(PO4)2]=c3(Mg2+)·c2(PO43-),已知Ksp[Mg3(PO4)2]=1.0×10-24,假设PO43-刚好完全除尽,即c(PO43-)=1.0×10-5mol·L-1,则 ,即溶液中Mg2+的浓度至少为
,即溶液中Mg2+的浓度至少为![]() ,故答案为:
,故答案为:![]() ;
;
(3)结合已知数据分析可知,“沉钒”过程中,pH由8.5到5.0主要发生的反应时V3O93-转化为V10O286-,反应的离子方程式为:10V3O93-+12H+===3V10O286-+6H2O,沉钒最终得到的物质时V2O5,所需要控制的pH约为2,故答案为:10V3O93-+12H+===3V10O286-+6H2O;2;V2O5;
(4)根据上述分析,“还原”过程中HCOOH将VO2+还原得到VO2+,自身被氧化为CO2,根据氧化还原反应的规律得到离子反应方程式为:2VO2++HCOOH+2H+===2VO2++CO2↑+2H2O,“转化”时,NH4HCO3与上一步还原得到VO2+反应得到产品,反应的离子反应方程式方程式为:5NH4++6VO2++17HCO3-+6H2O===(NH4)5(VO)6(CO3)4(OH)9·10H2O+13CO2↑,故答案为:2VO2++HCOOH+2H+===2VO2++CO2↑+2H2O;5NH4++6VO2++17HCO3-+6H2O===(NH4)5(VO)6(CO3)4(OH)9·10H2O+13CO2↑。

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案