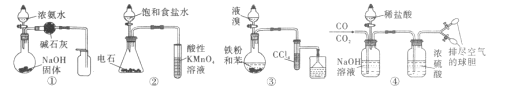
题目内容
【题目】某学习小组为了探究CH3COOH的电离情况,进行了如下实验。
(实验一)测定醋酸溶液中CH3COOH的物质的量浓度。
用 0.2000mol/L 的 NaOH 溶液滴定 20.00mL 醋酸溶液,3 次滴定所消耗NaOH溶液的体积如下:
实验次数 | 1 | 2 | 3 |
消耗NaOH 溶液的体积/mL | 20.05 | 20.00 | 19.95 |
(1)量取 20.00 mL 醋酸溶液所用的仪器是_____(填字母)
|
|
|
|
a | b | c | d |
(2)以上醋酸溶液中CH3COOH的物质的量浓度为_____
(实验二)探究浓度对CH3COOH电离程度的影响。
用 pH 计测定 25℃时不同浓度的醋酸的 pH,结果如下:
浓度/(mol·L-1) | 0.2000 | 0.1000 | 0.0100 |
pH | 2.83 | 2.88 | 3.38 |
(3)根据表中数据可知CH3COOH是_____电解质(填“强”或“弱”) 得出此结论的依据是_____
(4)写出CH3COOH的电离方程式_____
【答案】c 0.2000mol/L 弱 c(CH3COOH)为0.1000mol/L时pH>1,即c(H+)<0.1000mol/L,说明CH3COOH未完全电离(或c(CH3COOH)由0.1000mol/L变为0.01mol/L时pH变化小于1,说明醋酸未完全电离)。 CH3COOH![]() CH3COOˉ+H+
CH3COOˉ+H+
【解析】
(1)醋酸溶液显酸性,所以量取20.00 mL醋酸溶液需要用酸式滴定管,所以选c;
(2)醋酸和NaOH的反应方程式为CH3COOH+NaOH=CH3COONa+H2O,消耗的NaOH溶液的平均体积为![]() =20.00mL,所以c(CH3COOH)=
=20.00mL,所以c(CH3COOH)=![]() =0.2000mol/L;
=0.2000mol/L;
(3)c(CH3COOH)为0.1000mol/L时pH>1,即c(H+)<0.1000mol/L,说明CH3COOH未完全电离,即醋酸为弱电解质。(或c(CH3COOH)由0.1000mol/L变为0.01mol/L时pH变化小于1,说明醋酸未完全电离);
(4)CH3COOH的电离方程式为CH3COOH![]() CH3COOˉ+H+。
CH3COOˉ+H+。

 名校课堂系列答案
名校课堂系列答案【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
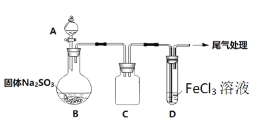
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO![]() Fe(HSO3)2+ 。
Fe(HSO3)2+ 。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______,装置C的作用为:________________。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:____________。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________。