题目内容
19.某同学在烧杯中加入5mL,1.0mol/L盐酸,再放入用砂纸打磨过的铝条,产生H2的速率水时间变化的关系,如图A所示.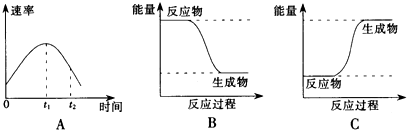
(1)该反应是放热(填“吸热”或“放热”)反应,其能量变化可用图中的B(填“B”或“C”)表示.
(2)图A中0-t1段化学反应速率变化的原因为反应放热,温度升高,速率增大.
分析 浓度越小,反应速率越小,温度越高,速率越大;放热反应中,反应物的总能量大于生成物的总能量,吸热反应中,反应物的总能量小于生成物的总能量;结合金属与酸的反应为放热反应分析.
解答 解:(1)在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量,则图象B正确,故答案为:放热;B;
(2)金属与酸的反应为放热反应,温度影响反应的速率,温度越高,反应的速率越快,故答案为:反应放热,温度升高,速率增大.
点评 本题考查化学反应与能量变化,为高频考点,侧重于学生的分析能力的考查,主要把握反应的特点,解题的关键是分析实验的过程,并结合题中所给的信息结合所学相关知识对问题进行探讨与分析.

练习册系列答案
相关题目
9.下列与有机物的结构、性质有关的叙述不正确的是( )
| A. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| B. | C5H12有3种同分异构体 | |
| C. | 氨基酸、淀粉均属于高分子化合物 | |
| D. | 碳原子之间只以单键相结合的链烃为烷烃 |
10.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且含锰元素的化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.336L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,充分反应后生成氯气的体积是(气体体积都在标准状况下测定)( )
| A. | 1.344L | B. | 1.568L | C. | 1.792L | D. | 2.016L |
14.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
| A. | 钡与水反应不如钠与水反应剧烈 | B. | 钡可以从KCl溶液中置换出钾 | ||
| C. | Ba(OH)2可与NH4Cl反应,反应放热 | D. | 碱性:KOH>Ba(OH)2>NaOH |
4.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中.理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 苯制备环己烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 铜和浓硝酸为原料生产硝酸铜 | D. | 苯与硝酸反成制备硝基苯 |
11.下列指定反应的离子方程式正确的是( )
| A. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | NaHCO3溶液与氢氧化钠溶液反应:HCO3-+2OH-═CO2↑+H2O | |
| C. | 用CH3COOH 溶液CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H20═Al(OH)3↓+HCO3- |
8. (重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告:
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
(2)实验结论:同周期从左至右元素金属性减弱,非金属性增强 (或金属性Na>Mg>Al;非金属性Cl>S).
(3)该同学又想起老师曾说过:构成原电池时一般来说活泼性强的金属做负极,于是他设计如图所示原电池装置,认为Mg做负极,Al做正极,可是实验结果却是在Mg上看到了气体,于是向老师求解才知影响铝在原电池中做正极或负极的因素之一是:电解质溶液的酸碱性,而此装置中负极发生的电极反应式为Al3+-3e-+4OH-=AlO2-+2H2O.
 (重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系). | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发生“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变为浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应开始不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶装沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填1-F) | B |
(3)该同学又想起老师曾说过:构成原电池时一般来说活泼性强的金属做负极,于是他设计如图所示原电池装置,认为Mg做负极,Al做正极,可是实验结果却是在Mg上看到了气体,于是向老师求解才知影响铝在原电池中做正极或负极的因素之一是:电解质溶液的酸碱性,而此装置中负极发生的电极反应式为Al3+-3e-+4OH-=AlO2-+2H2O.
 、
、 ;
; ;
;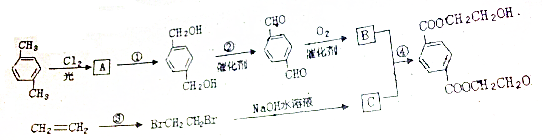
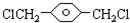 ,
,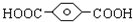 ,HOCH2CH2OH.
,HOCH2CH2OH.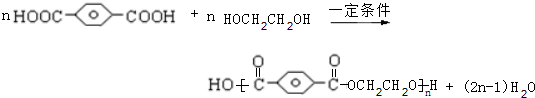 .
.