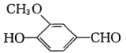
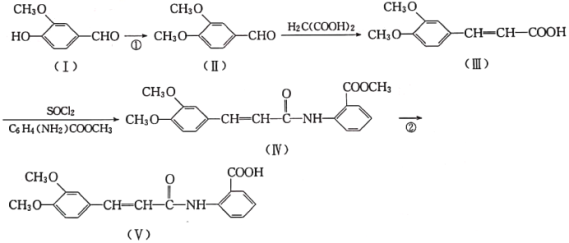
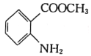
题目内容
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若向装有饱和FeCl3溶液的烧杯中分别滴入下列物质中,能形成胶体的是_______(填序号)。
a.冷水 b.沸水 c.NaOH浓溶液 d.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:_____________________
(3)用激光笔照射装有Fe(OH)3胶体的烧杯,能在侧面看到一条_________,这种现象称为丁达尔效应
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是________(填序号)。
a.分散质粒子大小不同 b.颜色不同 c.后者不稳定
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,变为黄色溶液,写出相关离子方程式 ____________________
【答案】b FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl 光亮的“通路” a Fe(OH)3(胶体)+3HCl =FeCl3+3H2O
Fe(OH)3(胶体)+3HCl 光亮的“通路” a Fe(OH)3(胶体)+3HCl =FeCl3+3H2O
【解析】
(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液;
(2)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
(3)胶体具有丁达尔性质,是区别其它分散系的独特性质;
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是分散质粒子直径大小不同。
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,生成FeCl3溶液,变为黄色溶液。
(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故合理选项是b;
(2)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故制备Fe(OH)3胶体的化学反应方程式:FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(3)胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,是区别其它分散系的独特性质,当让一束光线通过制得的Fe(OH)3胶体,从侧面观察到一条光亮的“通路”;
(4) Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是分散质粒子直径大小不同,故合理选项是a;
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,生成FeCl3溶液,变为黄色溶液,发生反应的方程式为:Fe(OH)3(胶体)+3HCl =FeCl3+3H2O。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
【题目】某化学工厂产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等离子。综合利用该酸洗废液的工艺流程如下:

已知:①Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
②金属离子开始沉淀和沉淀完全时的pH表③Ksp(CaF2)=4![]() 10-11
10-11
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
回答下列问题:
(1)再生酸中主要含有硝酸,采取减压蒸馏的原因是_______________________
(2)渣1的主要成份为______(填化学式)
(3)转化时发生反应的离子方程式______________________________
(4)用平衡移动的原理解释沉镍的原理_____________________________
(5)渣3的主要成分为氢氧化钙和_______________ 、_________________(填化学式)
(6)国家排放标准要求c(F-)≤3.8 mgL-1。残液中残留的Ca2+浓度至少应为_____mgL-1