题目内容
【题目】湿法炼锌厂在除杂过程中会产生大量铁矾渣。某黄钾铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO·Fe2O3及少量CaO、MgO、SiO2等。一种由黄钾铁矾渣制备复合镍锌铁氧体( NiZnFe4O8)的流程如下:

回答下列问题
(1)滤渣I的主要成分是___________。
(2)净化除杂阶段加入Fe粉时发生反应的离子方程式为___________、___________。已知:25℃时Ksp(CaF2)=2.7×10-11, Ksp (MgF2)=6.4×10-19。加入NH4F使Ca2+、Mg2+离子沉淀,若沉淀后溶液中c(Ca2+)=2.7×10-6mol·L-1,则c(Mg2+)=___________ mol·L-1。
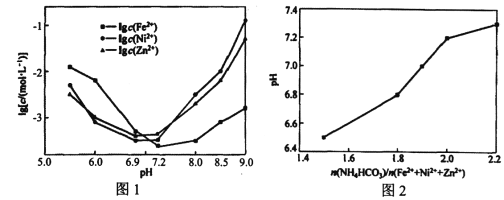
(3)在Fe2+、Ni2+、Zn2+共沉淀过程中,三种离子的损失浓度与pH的关系曲线如图所示,pH与n(NH4HCO3)︰n(Fe2++Ni2++Zn2+)的关系曲线如图所示。为提高原料利用率,n( NH4HCO3)︰n(Fe2++Ni2++Zn2+)最好控制在___________左右;按此比例,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的化学反应方程式为___________。
(4)铁氧体工艺阶段制备 NiZnFe4O8过程中,需加入___________剂(填“氧化”或“还原”)。按照上述流程,一座10万吨规模的锌厂每年产生黄钾铁矾渣约5万吨,Fe3+含量为27%,理论上每年可制备复合镍锌铁氧体(NiZnFe4O8,M=476g·mol-1)___________万吨(保留两位有效数字)
【答案】SiO2 2Fe3+ + Fe = 3Fe2+ Fe + 2H+ =Fe2+ + H2↑ 6.4×10-14 2.0 3MeSO4+6NH4HCO3=MeCO3·2Me(OH)2·2H2O↓+3(NH4)2SO4+5CO2↑ 氧化 4.3
【解析】
(1)SiO2不和硫酸反应,因而滤渣Ⅰ为SiO2。
(2)净化除杂阶段加入Fe粉与过量的稀硫酸置换出氢气,与Fe3+发生氧化还原反应,因而离子方程式为2Fe3+ + Fe = 3Fe2+ ,Fe + 2H+ =Fe2+ + H2↑。Ksp(CaF2)=c(Ca2+)c2(F-),带入数据,根据溶液中的钙离子浓度可以求出c(F-)=10-2.5mol/L,再根据Ksp(MgF2)=c(Mg2+)c2(F-),解得c(Mg2+)=6.4×10-14mol/L。
(3)观察图1可知pH=7.2时,三种离子的损失浓度最大,即沉淀达到最大值,因而此时的pH值最合理,结合图2,当pH等于7.2时,n( NH4HCO3)︰n(Fe2++Ni2++Zn2+)等于2.0,说明n( NH4HCO3)︰n(Fe2++Ni2++Zn2+)最好控制在2.0左右。根据滤液Ⅱ配料,可知阴离子还有SO42-,因而反应物为MeSO4和NH4HCO3,Me2+和HCO3-要发生双水解,除了信息给的沉淀,产物还有CO2和(NH4)2SO4,因而化学方程式为3MeSO4+6NH4HCO3=MeCO3·2Me(OH)2·2H2O↓+3(NH4)2SO4+5CO2↑。
(4)流程前期操作得到的是Fe2+,而铁氧体工艺阶段得到的 NiZnFe4O8铁元素是+3价,说明需要加入氧化剂。因2Fe3+ + Fe = 3Fe2+,说明3n(Fe3+)=2n(Fe2+),可知3m(Fe3+)=2m(Fe2+),所以流程中共加入铁元素的质量为5×0.27×3/2=2.025万吨,而NiZnFe4O8铁元素质量分数为56×4/476=47%,因而NiZnFe4O8的质量为2.025÷47%=4.3万吨。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡