题目内容
10.关于下列装置的说法正确的是( )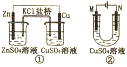
| A. | 装置中盐桥内的K+移向CuSO4溶液 | |
| B. | ①是将电能转变为化学能的装置 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置用于电解精炼钢,溶液中Cu2+的浓度保持不变 |
分析 A.溶液中阳离子向正极移动;
B.图1为原电池,图2为电解池;
C.电镀池中镀层金属做阳极,镀件做阴极;
D.电解精炼铜时,阳极上比铜活泼的金属也放电,阴极上只有铜离子放电.
解答 解:A.铜、锌形成原电池,锌的活泼性大于铜,所以锌为负极,铜为正极,原电池中阳离子移向正极,所以盐桥内的K+移向CuSO4溶液,故A正确;
B.图1为原电池,是将化学能转化为电能的装置,图2为电解池,是将电能转化为化学能的装置,故B错误;
C.若装置②用于铁棒镀铜,铜为镀层金属,应做阳极,所以N为铜棒,故C错误;
D.电解精炼铜时溶液中的Cu2+浓度减小,故D错误;
故选:A.
点评 本题考查了原电池和电解的相关知识,熟悉原电池、电解池工作原理、准确判断电极及发生反应是解题关键,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为:2FeCl3+Cu→2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液及其形成的判断正确的是( )
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
1.关于常温下0.1mol/L氨水(pH=11)的下列说法正确的是( )
| A. | 根据题中信息,可推断氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-) 的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
18.下列说法正确的是( )
| A. | 青铜、碳素钢和石英都是合金 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 乙醇与乙醛互为同分异构体,都能发生银镜反应 | |
| D. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
15.下列关于化学反应速率的说法中正确的是( )
| A. | 化学反应速率可用某时刻生成物的物质的量来表示 | |
| B. | 在同一反应中,用反应物或生成物表示的化学反应速率的值是相对的 | |
| C. | 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加 | |
| D. | 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率 |
2. 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
①2H++2e→H2↑ ②O2+4e+2H2O→4OH- ③2Cl--2e→Cl2↑
 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )①2H++2e→H2↑ ②O2+4e+2H2O→4OH- ③2Cl--2e→Cl2↑
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
19.向等物质的量浓度的NaOH和Ca(OH)2的混合液中通入一定量CO2.下列离子方程式与事实不相符的是( )
| A. | OH-+CO2→HCO3- | |
| B. | 2OH-+CO2→CO32-+H2O | |
| C. | Ca2++2OH-+CO2→CaCO3↓+H2O | |
| D. | Ca2++4OH-+2CO2→CaCO3↓+CO32-+2H2O |
12.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | CO和 N2为等电子体,22.4L的CO气体和1mol N2所含的电子数相等 | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 在标准状况下,30g福尔马林和22.4L三氧化硫所含氧原子数之比为1:3 |