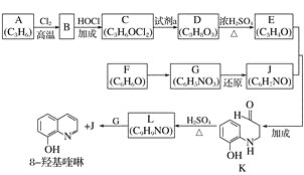
题目内容
【题目】甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1<0;②CO2(g)
H2O(l) ΔH1<0;②CO2(g)![]() CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)![]() CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
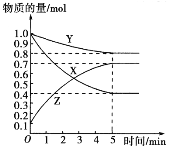
(2)该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
①下列叙述合确的是__________(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线 ___________________
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
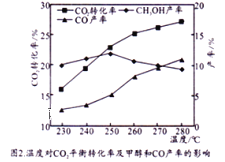
①由图2可知温度升高CO的产率上升,其主要原因可能是__________。
②由图2可知获取CH3OH最适宜的温度是_____。
(4)近几年开发的甲醇燃料电池的工作原理如图所示:
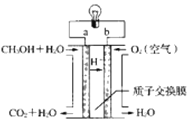
电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为____。
【答案】ΔH=2ΔH1-ΔH2-ΔH3BCD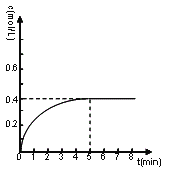 反应Ⅱ正反应是吸热反应,温度升高平衡正向移动,CO产率升高250℃CH3OH+H2O-6e-
反应Ⅱ正反应是吸热反应,温度升高平衡正向移动,CO产率升高250℃CH3OH+H2O-6e-![]() CO2↑+6H+
CO2↑+6H+
【解析】
(1)由已知,③为:CH3OH(l)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(l) ΔH3,根据盖斯定律,①×2-②-③得:CO(g)+2H2(g)
CO2(g)+2H2O(l) ΔH3,根据盖斯定律,①×2-②-③得:CO(g)+2H2(g)![]() CH3OH(l) ΔH=2ΔH1-ΔH2-ΔH3。
CH3OH(l) ΔH=2ΔH1-ΔH2-ΔH3。
(2)①A项,减小生成物浓度,化学平衡正向移动,正逆反应速率都减小,故A错误;
B项,增大压强,化学平衡向气体分子数减小的方向移动,因为该反应正向气体分子数减小,所以缩小容器的体积,压强变大,平衡将向右移动;体积缩小导致c(CO)变大,根据化学平衡移动原理,达到新平衡时c(CO)仍比原平衡时大,故B正确;
C项,催化剂能同等程度加快正逆反应速率,所以应选用乙催化剂,故C正确;
D项,由已知,5分钟反应达平衡时各物质的浓度为:c(CO)=0.1mol/L、c(H2)=0.2mol/L、c(CH3OH)=0.4mol/L,所以K=![]() =
=![]() =100,若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,此时c(CO)=0.5mol/L、c(H2)=0.2mol/L、c(CH3OH)=0.7mol/L,Q=
=100,若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,此时c(CO)=0.5mol/L、c(H2)=0.2mol/L、c(CH3OH)=0.7mol/L,Q=![]() =
=![]() =35<K,所以此时平衡正向移动,v正>v逆,故D正确。
=35<K,所以此时平衡正向移动,v正>v逆,故D正确。
综上分析,符合题意的选项为BCD。
②由已知,甲醇的初始物质的量浓度为0,5分钟反应达平衡,前面已经算出此时甲醇物质的量浓度为0.4mol/L,所以甲醇的物质的量浓度随时间的变化曲线可用如图表示: 。
。
(3)由图2可得,温度升高,CO2平衡转化率上升、CO的产率上升、温度高于250℃时甲醇的产率降低,则:①反应Ⅱ正反应是吸热反应,温度升高平衡正向移动,CO产率升高;②获取CH3OH最适宜的温度是250℃。
(4)由图可得,a电极原料是CH3OH和水,b电极原料为氧气,电解质溶液为稀硫酸,质子交换膜只允许质子和水分子通过,则a极为电池负极,发生氧化反应生成CO2和H+,电极反应式为:CH3OH+H2O-6e-![]() CO2↑+6H+。
CO2↑+6H+。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案