题目内容
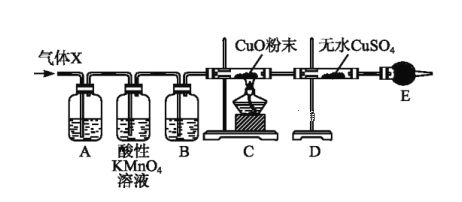
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):
试回答:
(1)上述实验中生成二氧化硫气体的化学方程式为_________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)丙同学在安装好装置后,必不可少的一步操作是__________。
(4)B中加入的试剂是______,其作用是___________。
(5)可以证明气体X中含有氢气的实验现象是;C中______,D中______。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?___________
为什么?_______________________________________________________________
【答案】Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O在锌与浓硫酸的反应中,H2SO4被消耗,且有水生成,c(H2SO4)逐渐减小,由浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气检验装置气密性浓硫酸吸收水蒸气黑色氧化铜粉末变成红色无水硫酸铜粉末变成蓝色不能混合气体通过KMnO4溶液时会带出水蒸气,干扰后续实验中H2的检验
ZnSO4+SO2↑+2H2O在锌与浓硫酸的反应中,H2SO4被消耗,且有水生成,c(H2SO4)逐渐减小,由浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气检验装置气密性浓硫酸吸收水蒸气黑色氧化铜粉末变成红色无水硫酸铜粉末变成蓝色不能混合气体通过KMnO4溶液时会带出水蒸气,干扰后续实验中H2的检验
【解析】
(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水;
(2)反应时浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;
(3)装置是气体验证试验,所以需要装置气密性完好;
(4)分析装置图可以知道,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰;
(5)证明生成的气体中含有水蒸气的现象是,C装置中黑色氧化铜变为红色铜,D装置中白色硫酸铜变为蓝色;混合气体通过酸性高锰酸钾溶液时带出水蒸气,若撤掉装置B不干燥气体,则不能证明水的来源,干扰氢气的检验。
(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O,
ZnSO4+SO2↑+2H2O,
因此,本题正确答案是:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O;
ZnSO4+SO2↑+2H2O;
(2)反应时浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2;
因此,本题正确答案是:在锌与浓硫酸的反应中,H2SO4被消耗,且有水生成,c(H2SO4)逐渐减小,由浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气;
(3)装置是气体验证试验,所以需要装置气密性完好,实验开始先检验装置的气密性,
因此,本题正确答案是:检验装置气密性;
(4)分析装置图可以知道,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,
因此,本题正确答案是:浓硫酸;吸收水蒸气;
(5)证明生成的气体中含有水蒸气的现象是,C装置中黑色氧化铜变为红色铜,D装置中白色硫酸铜变为蓝色;混合气体通过酸性高锰酸钾溶液时带出水蒸气,若撤掉装置B不干燥气体,则不能证明水的来源,干扰氢气的检验,
因此,本题正确答案是:无水硫酸铜粉末变成蓝色;不能;混合气体通过KMnO4溶液时会带出水蒸气,干扰后续实验中H2的检验。

【题目】为提纯下列物质(括号内为杂质),选用的除杂试剂和分离方法都正确的是
选项 | 物质 | 除杂试剂 | 分离方法 |
A | 二氧化硅(碳酸钙) | 氢氧化钠溶液 | 过滤 |
B | 硫酸铜溶液(硫酸铁) | 加入过量铜粉 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | SO2(CO2) | 碳酸钠溶液 | 洗气 |
A. AB. BC. CD. D