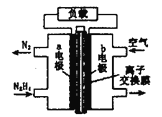
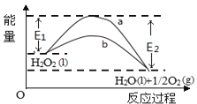
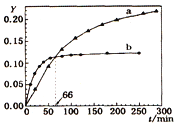
题目内容
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=10 mol·L-1·min-1
【答案】B
【解析】
注意比较反应速率快慢常用方法有:归一法,即按速率之比等于化学计量数之比转化为用同一物质表示的速率;比值法,即由某物质表示的速率与该物质的化学计量数之比,比值越大,速率越快,一般用比值法相对简单。
由比值法可得:v(A)/2=0.25mol·L-1· s-1,v(B)/1=0.3 mol·L-1· s-1,v(C)/3=0.8/3mol·L-1· s-1,注意D的单位需要换算,v(D)=10 mol·L-1·min-1=1/6 mol·L-1· s-1,v(D)/4=1/24 mol·L-1· s-1,反应速率最快的是v(B),故选B。

练习册系列答案
相关题目