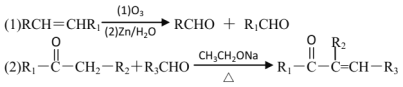
题目内容
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
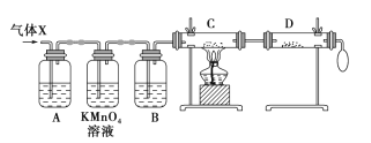
(1)A中加入的试剂可能是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是___________________________________。
【答案】品红溶液高锰酸钾溶液颜色变浅,但没有褪成无色C中黑色粉末变红色,D中白色粉末变蓝色
【解析】
锌与浓硫酸反应会生成SO2气体,锌与稀硫酸反应会生成H2,故气体X中主要含有SO2和H2,根据实验目的结合实验流程可得:A为检验SO2气体的装置;KMnO4为除去SO2气体的装置;B为干燥装置;C、D为检验氢气还原氧化铜产物的装置。
(1)由上述分析可知,A为检验SO2气体的装置,故A中加入的试剂可能是品红溶液。KMnO4为除去SO2气体的装置,若高锰酸钾溶液与B之间不再添加装置,则要证明SO2被全部吸收,需证明高锰酸钾溶液是过量的,则高锰酸钾溶液颜色变浅,但没有褪成无色,表明已达到使用高锰酸钾溶液的目的。
(2)本实验是通过证明氢气还原氧化铜的产物的方法,来证明气体X中混有较多氢气的,故C中黑色粉末(CuO)变红色(Cu),D中白色粉末(无水硫酸铜)变蓝色(CuSO45H2O),则说明是氢气还原了氧化铜,生成了铜单质和水。

练习册系列答案
相关题目