题目内容
【题目】硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示. 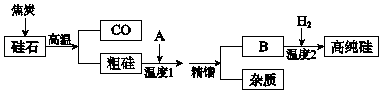
(1)从硅石中得到粗硅的化学方程式是 , 粗硅含有的杂质有铝、等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C ![]() SiC+2CO↑,该反应中的氧化剂是 .
SiC+2CO↑,该反应中的氧化剂是 .
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4 , 温度应控制的范围是(填序号).
物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
熔点/℃ | ﹣70 | ﹣128.2 | 306 | ﹣﹣ |
沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是 .
(4)若A是HCl,B是SiHCl3 , 生产过程中可循环利用的物质是 .
【答案】
(1)SiO2+2C ![]() Si+2CO↑;铁
Si+2CO↑;铁
(2)碳
(3)a; FeCl3、AlCl3
(4)HCl
【解析】解:(1)从硅石中得到粗硅的化学方程式是SiO2+2C ![]() Si+2CO↑,同时焦炭将Al2O3、Fe2O3还原为单质铝和铁;
Si+2CO↑,同时焦炭将Al2O3、Fe2O3还原为单质铝和铁;
所以答案是:SiO2+2C ![]() Si+2CO↑;铁;(2)反应SiO2+3C
Si+2CO↑;铁;(2)反应SiO2+3C ![]() SiC+2CO↑,C的化合价有升高到二氧化碳,也有降低到SiC,说明C既做氧化剂也做还原剂;
SiC+2CO↑,C的化合价有升高到二氧化碳,也有降低到SiC,说明C既做氧化剂也做还原剂;
所以答案是:碳;(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4,从表中数据可知,控制温度55~60℃时,SiCl4与 FeCl3、AlCl3分离;
所以答案是:a;FeCl3、AlCl3;(4)若A是HCl,B是SiHCl3,向B中通氢气发生反应SiHCl3+H2 ![]() Si+3HCl,HCl可循环利用,所以答案是:HCl.
Si+3HCl,HCl可循环利用,所以答案是:HCl.