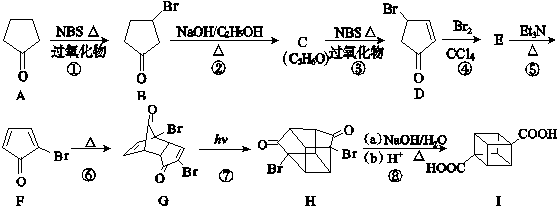
题目内容
【题目】下列有关钠的叙述正确的是( )
A. 钠是银白色金属,硬度很大 B. 钠在空气中燃烧生成氧化钠
C. 金属钠的熔点很高 D. 金属钠可以保存在煤油中
【答案】D
【解析】A.钠是银白色金属,有金属光泽,硬度较小,可以用小刀切割,故A错误;B.钠和氧气反应生成氧化钠,燃烧时生成过氧化钠,故B错误;C.钠和水反应时熔成小球,说明钠的熔点较低,故C错误;D与煤油不反应,且密度比煤油大,可保存在煤油中,故D正确;故选D。

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示. 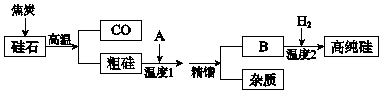
(1)从硅石中得到粗硅的化学方程式是 , 粗硅含有的杂质有铝、等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C ![]() SiC+2CO↑,该反应中的氧化剂是 .
SiC+2CO↑,该反应中的氧化剂是 .
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4 , 温度应控制的范围是(填序号).
物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
熔点/℃ | ﹣70 | ﹣128.2 | 306 | ﹣﹣ |
沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是 .
(4)若A是HCl,B是SiHCl3 , 生产过程中可循环利用的物质是 .
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 .
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4 , 从化学平衡的角度解释此方法能顺利制取TiCl4的原因 .
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4 , 装置如图1所示: 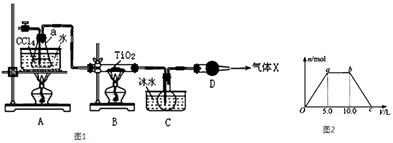
如表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 .
②本实验中仪器a采用题给的加热方式的突出优点是 .
③B中CCl4与TiO2发生反应的化学方程式是 .
④欲分离C装置中的TiCl4 , 应采用的实验操作为(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 .