题目内容
【题目】以NA代表阿伏伽德罗常数,下列说法正确的是( )
A.常温常压32g O2 含2NA个原子
B.标准状况下11.2L H2O 含有的原子数目为1.5NA
C.1mol的Cl﹣ 含有NA个电子
D.0.5mol/L的NaCl 溶液中Cl﹣的个数为0.5 NA
【答案】A
【解析】解:A.常温常压32g O2 含氧原子个数为: ![]() ×2×NA=2NA,故A正确;
×2×NA=2NA,故A正确;
B.标况下水是液体,不能使用气体摩尔体积,故B错误;
C.1mol的Cl﹣ 含有18NA个电子,故C错误;
D.溶液体积未知,无法计算氯离子个数,故D错误;
故选:A.
A.氧气是由氧原子构成,依据n= ![]() 计算;
计算;
B.气体摩尔体积使用对象为气体;
C.1个氯离子含有18个电子;
D.溶液体积未知.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
(1)真空碳热还原﹣氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJmol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJmol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJmol﹣1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= , T1℃时,该反应的平衡常数K= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的NO b.通入一定量的N2 c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=mol/L.NO的转化率(填“增大”、“减小”或“不变”).
(3)铝电池性能优越,Al﹣Ag2O电池可用作水下动力电源,其原理如图所示
请写出该电池正极反应式;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=(不考虑溶液体积的变化).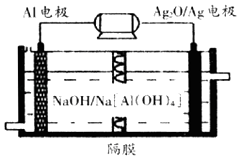
【题目】硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示. 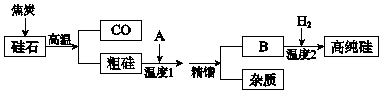
(1)从硅石中得到粗硅的化学方程式是 , 粗硅含有的杂质有铝、等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C ![]() SiC+2CO↑,该反应中的氧化剂是 .
SiC+2CO↑,该反应中的氧化剂是 .
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4 , 温度应控制的范围是(填序号).
物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
熔点/℃ | ﹣70 | ﹣128.2 | 306 | ﹣﹣ |
沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是 .
(4)若A是HCl,B是SiHCl3 , 生产过程中可循环利用的物质是 .
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 .
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4 , 从化学平衡的角度解释此方法能顺利制取TiCl4的原因 .
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4 , 装置如图1所示: 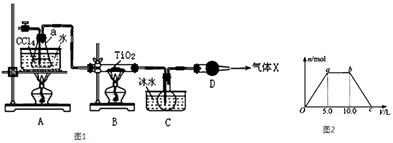
如表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 .
②本实验中仪器a采用题给的加热方式的突出优点是 .
③B中CCl4与TiO2发生反应的化学方程式是 .
④欲分离C装置中的TiCl4 , 应采用的实验操作为(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 .
