题目内容
【题目】用乙烯、甲苯、E三种原料合成高分子药物M和有机中间体L的路线如图: 
已知: 
Ⅲ.有机物L是一种六元环酯,M的分子式是(C15H16O6)n
(1)C中含氧官能团的名称 , D的结构简式
(2)E在KMO4/OH﹣中转化成F,F的结构简式 , H→J的反应类型 .
(3)H→L的化学反应方程式是 .
(4)K→M属于加聚反应,K的结构简式是 .
(5)写出一定量的C与足量NaOH溶液反应的化学方程式 .
(6)写出一种符合下列条件的C的同分异构体的结构简式 .
①属于芳香族化合物;
②能发生银镜反应;
③遇FeCl3溶液能发生显色反应
④核磁共振氢谱有4组峰,且峰面积之比为l:l:2:2.
【答案】
(1)羟基、羧基;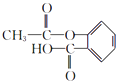
(2)![]() ;消去反应
;消去反应
(3)
(4)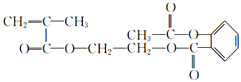
(5)![]()
(6) 或
或 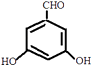 或
或 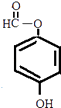
【解析】解:由反应信息Ⅰ可知,乙烯在高锰酸钾、碱性条件下被氧化生成B为HOCH2CH2OH.由反应信息Ⅱ可知, ![]() 与乙酸酐反应生成D为
与乙酸酐反应生成D为 ![]() .F发生催化氧化生成G,G与形成氢氧化铜反应生成H,则F为醇、G含有醛基、H含有羧基,L是六元环酯,由H、L的分子式可知,应是2分子H脱去2分子水发生酯化反应,故H中还含有﹣OH,且﹣OH、﹣COOH连接在同一碳原子上,该碳原子不含H原子,故H为
.F发生催化氧化生成G,G与形成氢氧化铜反应生成H,则F为醇、G含有醛基、H含有羧基,L是六元环酯,由H、L的分子式可知,应是2分子H脱去2分子水发生酯化反应,故H中还含有﹣OH,且﹣OH、﹣COOH连接在同一碳原子上,该碳原子不含H原子,故H为 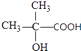 ,逆推可得G为
,逆推可得G为 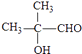 、F为
、F为  ,故E为(CH3)2C=CH2 , 在高锰酸钾、碱性条件下氧化生成F.B、D、J反应生成K,K→M属于加聚反应,M分子式是(Cl5Hl6O6)n , 由M的链节组成可知,应是1分子B、1分子D、1分子J反应生成K,故H在浓硫酸、加热条件下发生消去反应生成J为CH2=C(CH3)COOH,K为
,故E为(CH3)2C=CH2 , 在高锰酸钾、碱性条件下氧化生成F.B、D、J反应生成K,K→M属于加聚反应,M分子式是(Cl5Hl6O6)n , 由M的链节组成可知,应是1分子B、1分子D、1分子J反应生成K,故H在浓硫酸、加热条件下发生消去反应生成J为CH2=C(CH3)COOH,K为  、M为
、M为  ,(1)由C的结构简式可知,C中含氧官能团的名称为羟基、羧基,D为
,(1)由C的结构简式可知,C中含氧官能团的名称为羟基、羧基,D为 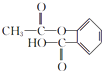 ,所以答案是:羟基、羧基;
,所以答案是:羟基、羧基; 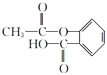 ;(2)根据上面的分析可知,F为
;(2)根据上面的分析可知,F为 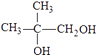 ,H→J的反应类型消去反应,
,H→J的反应类型消去反应,
所以答案是: 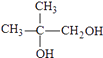 ;消去反应;(3)H→L的化学反应方程式是
;消去反应;(3)H→L的化学反应方程式是  ,
,
所以答案是: 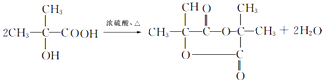 ;(4)根据上面的分析可知,K的结构简式是
;(4)根据上面的分析可知,K的结构简式是  ,
,
所以答案是:  ;(5)一定量的C与足量NaOH溶液反应的化学方程式为
;(5)一定量的C与足量NaOH溶液反应的化学方程式为 ![]() ,
,
所以答案是: ![]() ;(6)符合下列条件的C(
;(6)符合下列条件的C( ![]() )的同分异构体:
)的同分异构体:
①属于芳香族化合物,含有苯环;②能发生银镜反应,含有﹣CHO或﹣OOCH,若为﹣CHO,则还含有2个﹣OH,若为﹣OOCH,则还含有1个﹣OH.③核磁共振氢谱有4组峰,且峰面积之比为1:1:2:2,符合条件的同分异构体为: 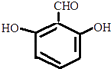 、
、  、
、 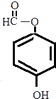 ,
,
所以答案是:  或
或  或
或 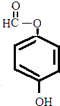 .
.

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案【题目】硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示. 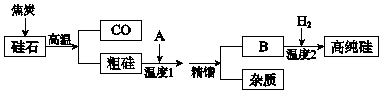
(1)从硅石中得到粗硅的化学方程式是 , 粗硅含有的杂质有铝、等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C ![]() SiC+2CO↑,该反应中的氧化剂是 .
SiC+2CO↑,该反应中的氧化剂是 .
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4 , 温度应控制的范围是(填序号).
物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
熔点/℃ | ﹣70 | ﹣128.2 | 306 | ﹣﹣ |
沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是 .
(4)若A是HCl,B是SiHCl3 , 生产过程中可循环利用的物质是 .
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 .
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4 , 从化学平衡的角度解释此方法能顺利制取TiCl4的原因 .
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4 , 装置如图1所示: 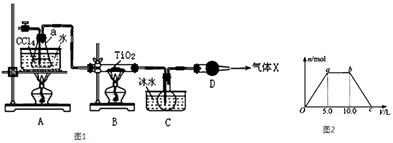
如表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 .
②本实验中仪器a采用题给的加热方式的突出优点是 .
③B中CCl4与TiO2发生反应的化学方程式是 .
④欲分离C装置中的TiCl4 , 应采用的实验操作为(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 .