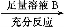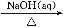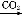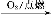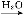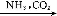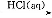题目内容
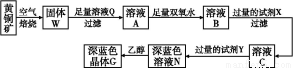
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种)。
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
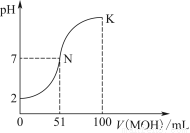
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是 。
(1)将黄铜矿粉碎、升高温度、增大空气流速(任选两种)
(2)2Fe2++2H++H2O2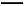 2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
(3)1×10-5 取一小片pH试纸放在玻璃片或表面皿上,用玻璃棒或胶头滴管取待测液点在pH试纸中部,待颜色变化稳定后与标准比色卡对比,读出pH
(4)K=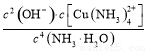
(5)降低G的溶解度,促进深蓝色晶体析出
【解析】(1)对于固体反应物燃烧来讲,加快化学反应速率的措施有:①增大固体接触面积;②升高温度;③增大空气流速(即增大O2浓度);④利用超声波等;结合本题的情况,①②③都符合。
(2)从该题的工艺流程,再结合产物的阴离子,溶液Q应为H2SO4溶液,则溶液A中有:Fe2+、Fe3+、Cu2+和过量H2SO4,再结合所给数据,知此工艺应将Fe2+ Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O
Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+
Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+ Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
(3)由上面知溶液C主要为CuSO4溶液,则加入Y后能生成[Cu(NH3)4]SO4,则Y为氨水,NH3·H2O N
N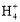 +OH-,K=
+OH-,K=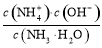 =
=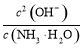 =
=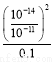 =
=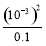 =
=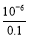 =10-5。
=10-5。
(4)书写时,氢氧化铜固体和水不计入表达式。
(5)深蓝色晶体的主要成分是[Cu(NH3)4]SO4·H2O,加入乙醇的目的是降低其溶解度,促进晶体析出。

 名校课堂系列答案
名校课堂系列答案