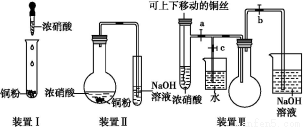
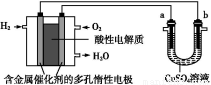
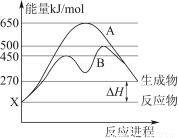
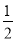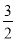题目内容
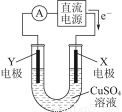
1 L K2SO4和CuSO4的混合溶液中c(S )=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
)=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.1.0 mol·L-1 D.0.5 mol·L-1
A
【解析】依题意,阳极反应:4OH--4e-=O2↑+2H2O;阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑。则生成22.4 L O2、H2分别转移4 mol e-、2 mol e-,根据得失电子守恒,Cu2+转移2 mol e-,则n(Cu2+)=1 mol,c(Cu2+)= 1 mol·L-1,根据电荷守恒:c(K+)+2c(Cu2+)=2c(S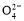 ),c(K+)=2.0 mol·L-1。
),c(K+)=2.0 mol·L-1。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
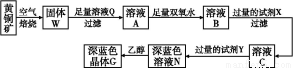
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种)。
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是 。
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | HA的物质的 量浓度(mol·L-1) | NaOH的物质的 量浓度(mol·L-1) | 混合后溶 液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.两者相等D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。