题目内容
下列说法正确的是( )
A.Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水
B.向硅酸钠溶液中滴加盐酸,有白色凝胶生成
C.向AlCl3溶液中逐滴滴加氨水至过量,先出现白色沉淀后溶解
D.工业上可以电解氯化镁溶液制取金属镁
B
【解析】Na2O2与水的反应中,Na2O2既是氧化剂也是还原剂,A错;向硅酸钠溶液中滴加盐酸,会生成白色的H2SiO3凝胶,B正确;Al(OH)3不能溶于弱碱,所以当氨水过量时,白色沉淀不会溶解,C错;工业上是通过电解熔融氯化镁来制取金属镁,D错;

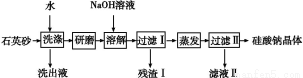
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:

已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种)。
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是 。