题目内容
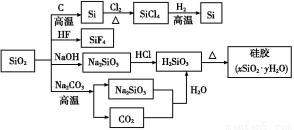
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物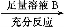 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施
B
【解析】因为盐酸或NaOH溶液都只能溶解金属铝,则可以通过生成氢气的量计算出金属铝的质量,方案Ⅱ则直接测得金属铜的质量,进一步计算出铜的质量分数,A正确;若A选稀硝酸,则生成NO气体,测定NO的气体体积要避免被空气氧化为NO2,又2NO2 N2O4,会使测得气体体积偏小。铜和铝都能溶于稀硝酸,所以溶液B不能是稀硝酸,否则不会有固体剩余,B不正确;当溶液B选用浓硝酸,铜溶解于浓硝酸;铝发生钝化,表面生成一层氧化膜,故测得固体的质量为铝和部分氧化铝的质量,则计算出铜的质量偏小,最终测得铜的质量分数偏小,C正确;对于气体的体积不便于测定(需要考虑温度、压强等),而固体的质量则易于测定,D正确。
N2O4,会使测得气体体积偏小。铜和铝都能溶于稀硝酸,所以溶液B不能是稀硝酸,否则不会有固体剩余,B不正确;当溶液B选用浓硝酸,铜溶解于浓硝酸;铝发生钝化,表面生成一层氧化膜,故测得固体的质量为铝和部分氧化铝的质量,则计算出铜的质量偏小,最终测得铜的质量分数偏小,C正确;对于气体的体积不便于测定(需要考虑温度、压强等),而固体的质量则易于测定,D正确。

 学业测评一课一测系列答案
学业测评一课一测系列答案工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种)。
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是 。
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由 组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
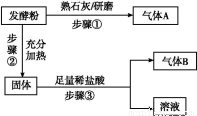
(2)结合步骤①~③分析,气体A为 ,该发酵粉的成分为 (填化学式)。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由: 。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/L NaOH溶液
写出实验步骤、预期现象和结论。
实验步骤 | 预期现象和结论 |
步骤1:取少量样品溶于足量的盐酸后,将溶液分成两份,分别装入A、B试管中 |
|
步骤2:
| ,证明有Na+,发酵粉中有NaHCO3 |
步骤3:
| ,结合步骤2中的结论,假设2成立 |
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | HA的物质的 量浓度(mol·L-1) | NaOH的物质的 量浓度(mol·L-1) | 混合后溶 液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.两者相等D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。