题目内容
【题目】化学反应2SO2(g)+O2(g)![]() 2SO3(g)是硫酸制造工业的基本反应。将0.050 mol SO2(g)和0.030mol O2(g)注入体积为1.0L的密闭反应器,并置于某较高温度下的恒温环境中,达化学平衡后,测得反应器中有0.040 mol SO3(g),求该温度下反应的平衡常数及SO2、O2的平衡转化率________。
2SO3(g)是硫酸制造工业的基本反应。将0.050 mol SO2(g)和0.030mol O2(g)注入体积为1.0L的密闭反应器,并置于某较高温度下的恒温环境中,达化学平衡后,测得反应器中有0.040 mol SO3(g),求该温度下反应的平衡常数及SO2、O2的平衡转化率________。
【答案】1600;80%;66.7%
【解析】
根据关系式列出“三步走”,再根据平衡常数表达式计算,再计算转化率。
⑴达到化学平衡后,测的反应器中有0.04mol SO3(g),则: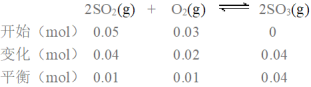
容器的体积为1L,故SO2、O2、SO3的平衡浓度分别为:0.01 mol/L、0.01 mol/L、0.04mol/L,所以该温度下平衡常数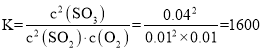 ;二氧化硫的转化率为:
;二氧化硫的转化率为:![]() ;氧气的转化率为:
;氧气的转化率为:![]() ;故答案为:1600;80%;66.7%。
;故答案为:1600;80%;66.7%。

【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
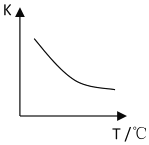
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
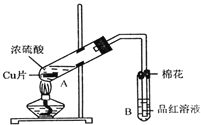
【题目】某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象______.
(2)写出A中反应的化学方程式______
(3)继续向A试管中加入![]() ,发现铜片溶解,反应的离子方程式为:______.
,发现铜片溶解,反应的离子方程式为:______.
(4)若仍不补充浓硫酸,只要求使铜片溶解,也可以加入![]() 填写两种属于不同类别物质的化学式
填写两种属于不同类别物质的化学式![]() ______、______.
______、______.
(5)![]() 试管口的棉花应沾有的试剂是______.
试管口的棉花应沾有的试剂是______.
小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体![]() 小组成员采用加热法测定该晶体里结晶水x的值.
小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量______次;
②下面是其中一次实验的数据:
坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
|
|
|
根据上表数据计算判断x的实测值比理论值![]() ______
______![]() 填“偏大”、“偏小”
填“偏大”、“偏小”![]() ,这次实验中产生误差的原因可能是______
,这次实验中产生误差的原因可能是______![]() 填序号
填序号![]()
A.硫酸铜晶体中含有不挥发的杂质![]() 实验前晶体表面有湿存水
实验前晶体表面有湿存水
C.加热时有晶体飞溅出去![]() 加热失水后露置在空气中冷却.
加热失水后露置在空气中冷却.