题目内容
【题目】A、B、C、D四种元素在元素周期表中的位置如图所示。

请回答下列问题:
(1)A的元素名称是___,它在元素周期表第___周期,第___族。
(2)A、B、C相比,其原子半径由大到小的顺序是___(用元素符号表示,下同)。
(3)C与D相比,非金属性较强的是___,能证明这一结论的事实是___(用化学方程式表示)。
【答案】氧 二 VIA Na>Si>O S H2SO4+Na2SiO3=Na2SO4+H2SiO3↓
【解析】
分析题给的部分周期表,根据各元素在元素周期表中的位置进行推断分析。可知A位于元素周期表中第二周期第VIA族,则A为O元素;D为S元素;B位于元素周期表中第三周期第IA族,可知B为Na元素;C位于元素周期表中第三周期第ⅣA族,为Si元素。据此分析。
(1)由分析可知,A为氧元素,在元素周期表中位于第二周期第VIA族。答案为:氧;二;VIA;
(2)根据元素周期律,同一周期从左至右,原子半径逐渐减小,可知原子半径:Na>Si;由电子层数越多,原子半径越大,可知原子半径:Na>Si>O;答案为:Na>Si>O;
(3)根据元素周期律,同一周期从左至右,元素的金属性逐渐减弱,非金属性逐渐增强,故C与D相比,非金属性较强的是S;可通过比较元素最高价氧化物的水化物的酸性强弱来证明,涉及的反应方程式为:H2SO4+Na2SiO3=Na2SO4+H2SiO3↓;答案为:S;H2SO4+Na2SiO3=Na2SO4+H2SiO3↓。

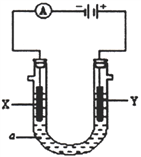
【题目】实验室制备1,2-二溴乙烷的反应中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
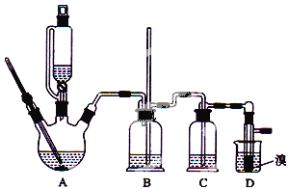
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此实验中,反应方程式为:_________;________。
(2)要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用_________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)判断该制备反应已经结束的最简单方法是_____________;
(6)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是_____________________。