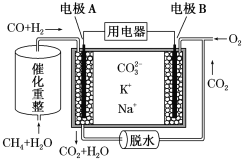
题目内容
【题目】某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。

(1)反应开始至2min,Y的平均反应速率____________________.
(2)分析有关数据,写出X、Y、Z的反应方程式____________________.
(3)写出提高Y的转化率的两个措施____________________,____________________。
【答案】0.03 molL-1min-1 X(g)+3Y(g)![]() 2Z(g) ①增大压强 ②增大X的浓度
2Z(g) ①增大压强 ②增大X的浓度
【解析】
⑴根据速率公式进行计算。
⑵通过图像推出反应物和生成物,再根据改变量之比等于计算系数之比。
⑶提高转化率的途径一般是不增加原物质的基础上通过平衡正向移动来提高,可能是加压或则加另外一种反应物。
⑴反应开始至2min时,Y的物质的量减少了1.0mol0.7mol=0.3mol,所以反应速率是![]() ,故答案为:0.03 molL-1min-1。
,故答案为:0.03 molL-1min-1。
⑵根据图象可知X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,且改变量分别是0.1mol、0.3mol、0.2mol,由于改变量之比等于相应的化学计量数之比,所以其系数之比为0.1mol:0.3mol:0.2mol=1:3:2,所以其方程式为X(g)+3Y(g)![]() 2Z(g),故答案为:X(g)+3Y(g)
2Z(g),故答案为:X(g)+3Y(g)![]() 2Z(g)。
2Z(g)。
⑶提高Y的转化率,则平衡正移,已知该反应正方向为体积减小的方向,所以增大压强平衡正移,增大X的浓度,平衡正移Y的转化率增大,故答案为:①增大压强,②增大X的浓度。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目